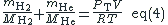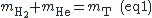Inscription / Connexion Nouveau Sujet
Exercices gaz parfaits
Bonjour, j'ai un devoir à rendre en chimie, j'ai réussi à tout faire sauf un. Le prof récompensera celui qui saura le faire alors j'aimerais bien que ce soit moi 
Le problème est que le prof nous a dit que c'était avec un système d'équation à 2 inconnues... mais le problème est que comme en math on avance pas, je ne sais pas comment faire. J'aimerais demander votre aide parce que je ne sais pas de quoi partir. Merci
L'énoncé :
- 17,2g d'un mélange d'un mélange d'hydrogène et d'hélium sont contenus dans un récipient de 118L à la température de 20°C (soit 293,15 K). Sachant que la pression est de 130709,25 Pa (soit 1,29 atm). Trouver la composition pondérale du mélange. (Réponses : 8,12g de H2 et 9,08g d'He)
soit x la qté de matière de He et y la qté de matière de H2
Exprime m(He) en fonction de x et m(H2) en fonction de y
Exprime en fonction de x et y la masse du mélange .Cela donne une première équation
Calcule x+y en utilisant PV=nRT .(dans ce cas n=x+y)
Cela donne une deuxième équation.
Exprime x en fonction de y dans une des équation et reporte cette expression dans l'autre équation .
calcule y puis x
calcule m(He) et m(H2)
Je comprend pour la 1e equation (je pense) : ça me donnerai ça :
n=PV/RT  (1,29
(1,29 118)/0.082
118)/0.082 293,15
293,15
= 6,332 mol
donc 
(2 accolades pour 1 grande)
{ nHe+H2 = 6,332 mol
{ nHe= nHe+H2 - nH2 (?)
J'ai tout très bien tout compris 
en reportant dans (2)
On résout le système de deux équations à deux inconnues :
Application numérique :
On résout le système de deux équations à deux inconnues :
et l'on obtient g et
g.
 Oh mon dieu c'est quoi ce truc ?! J'aurai jamais pu faire ça.
Oh mon dieu c'est quoi ce truc ?! J'aurai jamais pu faire ça.
Sinon un immense merci, j'ai compris la plupart sauf comment on passe de : (des images en bas) au résultat de l'application numérique ?