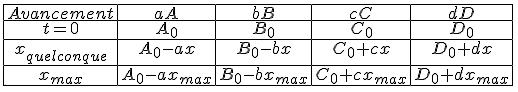Inscription / Connexion Nouveau Sujet
exercice reaction chimique
bonjour,
j'ai un exercice sur les réaction chimique j'ai répondue a la première question mais j'ai un peu de difficulté pour les autres :
1) On utilise 11,2g de fer, quel est le nombre de mole de fer utilisé : j'ai répondu suivant cette formule n=m/M ce qui ma donné 11,2/56 donc 0,2
2) En déduire le nombre de mole d'oxyde de fer formé.
3) Calculer la masse d'oxyde de fer formé a la fin de la réaction.
Données : M(Fe) = 56g/mol ; M(O) = 16g/mol
Voila merci de m'aider si vous le pouvez.
salut  !
!
1) sans unité ça ne veut rien dire
2) tu écris la réaction chimique se produisant et tu fais un tableau d'avancement
ah non moi je n'ai jamais fait sa de ma vie
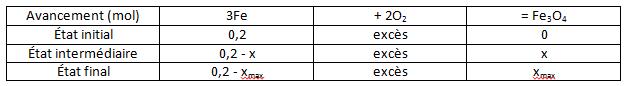
Voici la réaction : 3Fe + 2O2 + Fe3O4
mais je comprend a partir des données etc comment je peux déduire le nombre de moles d'oxyde de fer utilisé et calculer la masse d'oxyde de fer a la fin de la réaction. Et non nous n'avons jamais fait ce genre de tableau
moi la seule chose qu'on a vu sur sa c'est la formule n=m/M donc vraiment la je sais pas du tout comment faire donc si tu pouvais me le dire sa serai sympa.
ce serai cool si tu pouvais faire les 2 questions ou j'y arrive pas avec les explications sa me permettrai de comprendre.
1) On utilise 11,2g de fer, quel est le nombre de mole de fer utilisé : j'ai répondu suivant cette formule n=m/M ce qui ma donné 11,2/56 donc 0,2
2) En déduire le nombre de mole d'oxyde de fer formé.
3) Calculer la masse d'oxyde de fer formé a la fin de la réaction.
Données : M(Fe) = 56g/mol ; M(O) = 16g/mol
1) n = m/M = 11,2/56 = 0,20 mol
2) voici le tableau [img1]
Le dioxygène est en excès car tu en trouves autant que tu veux dans une oxydation à l'air libre
Donc xmax = 0,2 mol
D'où n(Fe3O4) = xmax = 0,2 mol
Ok? Je te laisse faire pour la masse