Inscription / Connexion Nouveau Sujet
exercice chimie
Bonjour,
Pourriez vous me dire si mon exercice est juste? Si non, pourriez vous m'expliquer où est mon erreur?
Voici l'énoncé :
La formule brute de l'acide oxalique est H2C2O4. On titre un volume V1=20,0mL d'une solution d'acide oxalique de concentration c1 inconnue à l'aide d'une solution acidifiée de permanganate de potassium de concentration c2=5,00.10-2mol.L-1. On trouve un volume équivalent V&q =13,4mL. On connait les couples CO2(g)/H2C2O4(aq) et MnO4-(aq)/Mn2+(aq) et sait que l'ion permanganate est la seule espèce colorée.
1)Ecrire l'équation de la réaction de titrage et explique comment repérer l'équivalence.
2)Déterminer c1.
______________________________________
2CO2+2H++2e-=H2C2O4 X5
Mn2++4H2O = MnO4-+8H++5e- X2
2MnO4-+6H++5H2C2O4 10CO2+2Mn2++8H2O
10CO2+2Mn2++8H2O
c2Véq-2xe=0
c2Véq=2xe
xe=(c2Véq)/2
c1V1-5xe=0
c1V1=5xe
xe=(c1V1)/5
c1=(5c2V2)/(2V1) = 8,38.10-2 mol/L
Puisque le réactif titrant est la seule espèce colorée, l'équivalence est repérée à l'apparition de la teinte.
Ce n'est pas très bien rédigé, trouvez vous la même chose?
Merci
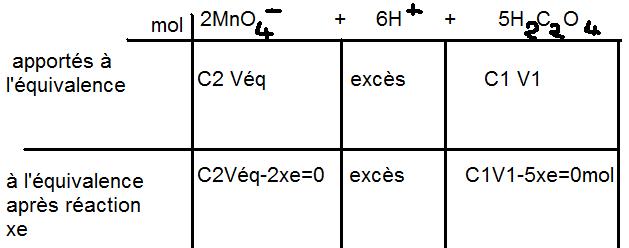
Bonjour bonjour 
Alors alors, ah, les dosages, voyons cela.
Eh bien, c'est parfait, je trouve cela aussi.
Pas la peine cependant de perdre du temps sur le tableau d'avancement écrit littéralement ( sauf si cela est demandé ).
En effet, à l'équivalence, nous sommes dans les proportions stoechiométriques, soit :
C2Veq/ 2 = C1V1/5 soit C1= 5C2Veq/2V1. Et l'on retrouve bien le résultat.
Et en effet, l'équivalence se repère à la persistance de la couleur violette dans la solution de l'acide oxalique.



