Inscription / Connexion Nouveau Sujet
Exercice avancement
Bonjour,
Je n'arrive pas à terminer mon exercice de chimie. Je souhaiterais obtenir votre aide.
Merci.
Enoncé
Un chimiste maladroit casse le réservoir dans lequel s'est produit une réaction. Or, au contact de l'air, le monoxyde d'azote NO se transforme en dioxyde d'azote NO2, gaz malodorant et de couleur rousse. Cette transformation est modélisée par la réaction :
2 NO (g) + O2 (g) ---> 2 NO2 (g)
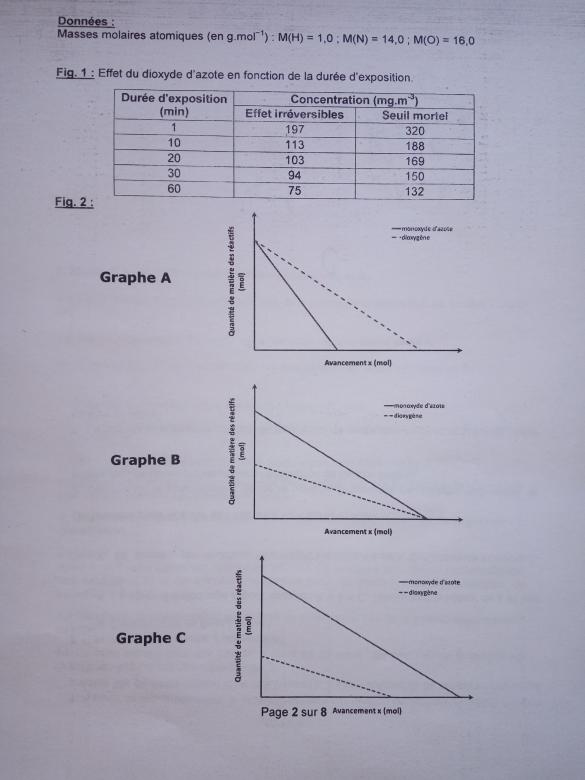
Ce gaz est toxique pour l'être humain. Le tableau de la fig. 1 donne la durée d'exposition
avant l'apparition d'effets néfastes irréversibles pour la santé ou la mort en fonction de la concentration en dioxyde d'azote dans l'air en mg/m3. On suppose que la totalité du monoxyde d'azote formé est transformée en dioxyde d'azote et relâchée par
accident dans une pièce de 150 m3. Pour les besoins de l'exercice, on supposera que le gaz s'est instantanément répandu dans toute la pièce.
Note : On a nf(NO) = 1.44 mol
3a. Montrer que mf(NO2) = 66,2 g de dioxyde d'azote NO2 ont été produit.
3b. Le gaz formé représente-t-il un danger immédiat pour le chimiste? Si oui, de combien de temps dispose-t—il pour évacuer de la pièce ?
On a représenté sur trois graphiques A, B et C (fig. 2) les évolutions possibles des quantités de matière des réactifs de la réaction en fonction de l'avancement. On suppose que la pièce contient initialement nf(O2) = 2880 mol de dioxygène.
4a. L'allure duquel des graphes A, B ou C correspond-elle à la situation (note: l'échelle
n'est pas respectée en termes de proportions)? Justifier.
4b. Calculer la quantité de monoxyde d'azote ni(NO) qui serait nécessaire pour épuiser la totalité du dioxygène dans la pièce.
4c. Lequel des'graphes A, B ou C représente alors la situation précédente ? Justifier.
Mes réponses
3a)
On a à l'état final :
nf(NO) - 2 * xmax = 0
xmax = nf(NO)/2 = 0.72 mol
D'après l'énoncé, on sait que le monoxyde d'azote est le réactif limitant.
nf(NO2) = 2 * xmax = 2 * 0.72 = 1.44 mol
Donc mf(NO2) = nf(NO2) * M(NO2) = 1.44 * (14+2*16) = 66.2 g = 66.2 * 103 mg
3b) On sait d'après la fig 1 que la concentration est en mg.m-3
Donc la concentration de gaz est :
nf(NO2)/Volume de la pièce = 66.2 * 103 mg / 150 m3 = 441.33 mg.m-3
Ensuite j'ai essayé de faire un produit en croix avec l'aide du tableau de la fig 1 :
441.33 mg.m-3 <-> ? s
197 mg.m-3 <-> 60 s
J'obtiens alors une durée de 134.4 secondes. Je trouve ce résultat aberrant. Mais je ne vois pas comment répondre à la question.
4a) Comme je sais que le monoxyde de carbone est le réactif limitant, je pense que l'allure du graph A correspond à la situation car l'avancement maximale xmax y est le plus petit.
4b) Je n'arrive pas à aborder la question
Salut,
Tout d'abord, c'est agréable de lire un sujet avec les formules de politesse et des propositions de résolution ! Le seul conseil que je peux te donner la prochaine fois c'est de recopier intégralement l'énoncé de ton exercice, y compris les questions traitées et pour lesquelles tu n'estimes pas avoir besoin d'aide.
__________________________________
3.a. TB !
3.b. TB pour le calcul de la concentration en dioxyde d'azote formée dans la pièce.
Tu constates d'ores et déjà que tu es au-dessus du seuil mortel pour 1 min d'exposition, tu sais donc que tu as moins d'1 min pour évacuer la pièce.
Tu peux affiner en traçant ton graphe sur la calculatrice et en faisant une interpolation.
4.a. Il faut justifier ton choix :
Le graphe C n'est pas représentatif car il suppose que le dioxygène est le réactif limitant, ce qui n'est pas conforme aux hypothèses avancées par l'énoncé.
Le graphe B serait correct si les réactifs étaient introduits dans des proportions stoechiométriques, ce qui n'est pas le cas ici puisque le monoxyde est supposé être le réactif limitant.
On peut le confirmer en calculant la quantité de matière initiale contenue dans la pièce à 20°C : V(air) = 150 m3.
Or l'air possède approximativement 21% d'O2, donc V(O2) = 0,21*150 = 31,5 m3 = 315 dm3 = 31,5.103 L
donc la quantité de matière initiale est n(O2) = V(O2)/Vm = 31,5.103/24 = 1,31.103 mol
Il est donc introduit en très large excès dans la réaction.
C'est donc le graphe qui est le plus représentatif de la réaction.
Je te laisse poursuivre 
Salut,
Tout d'abord, c'est agréable de lire un sujet avec les formules de politesse et des propositions de résolution ! Le seul conseil que je peux te donner la prochaine fois c'est de recopier intégralement l'énoncé de ton exercice, y compris les questions traitées et pour lesquelles tu n'estimes pas avoir besoin d'aide.
Je te laisse poursuivre

Bonjour,
J'ai pu comprendre l'exercice grâce à vos vos explications.
Je vous remercie pour votre aide.
Bonne journée à vous




