Inscription / Connexion Nouveau Sujet
Excercie de Chimie
]Bonjour j'ai été Absent pendant 2 semaines et du coup j'ai râté pas mal de cours....
Je comprends rien à ces exercices. Ce n'est pas noté mais j'aimerais bien une solution expliquée pour bien comprendre le cours!
MERCI BEAUCOUP
I) Le dentifrice contient un constituant actif appellé fluorure de sodim
1) Donner la configuration electronique des atomes de Fluor 9f ET de sodim 11Na
2)En déduire les ions auxquels ils donnent naissance lors d'une réaction chimique
3)Proposer une formule chimique pour le fluorure de sodiumn celle ci devant tenir comtpe de la neutralité éléctronique de l'édifice
II) Représentation de molécules
1) Donner la représentation de Lewis de l'atome de soufre 16s
2) Donner la représentation de Lewis de la molécule d'ocasoufre S8. Cette mollécule est-elle cyclique?
3) Trouver des représentations des molécules suivantes
- Ethanamine C2H5NH2
- Acide éthanoïque CH3COOH
- Acélytène C2H2
III) Proportion et molécule
On considère une molécule contenant 12 atomes au total, de formule brute CxHyOz : 25,0 % de l'ensemble des atomes sont des atomes de carbone, 66,7 sont des atimes d'hydrogène et le reste des atomes d'oxygène
1) Déterminer les valeurs de x y z puis donner la formule brute de la molécule
2) En déduire de représentations de Lewis possibles
Bonjour,
I)
1) Combien d'électrons ont les atomes de Fluor et de Sodium?
Etablir leur configuration électronique, c'est remplir leurs différentes couches électroniques: K, L, M.
On remplit d'abord la couche K, qui peut accueillir 2 électrons, puis la couche L qui peut en accueillir 8 puis la couche M.
exemple avec l'atome de carbone 6C qui contient 6 protons donc 6 électrons: (K)2 (L)4
2) Il faut utiliser la règle de l'octet ou du duet: La dernière couche remplie est la couche externe. Lors d'une réaction chimique, les atomes vont évoluer de façon à avoir une couche externe pleine ( c'est à dire: (K)2 ou bien (K)2 (L)8 ou bien (K)2 (L)8 (M)8
exemple du chlore Cl (Z=17) : (K)2 (L)8 (M)7
Il a 7 électrons sur sa couche externe donc pour être stable, il va avoir tendance à gagner un électron (donc acquérir une charge - ) pour avoir la configuration électronique: (K)2 (L)8 (M)8. Il va donc donner l'ion Cl-
Je te laisse faire la même chose pour le fluor et le sodium.
Si ce n'est pas clair ou si tu veux d'autres explications, demande moi.
Je t'aiderai pour la suite après.
Thetys. 
Bonjour Thetys, merci beaucoup de me venir en aide.
J'ai bien compris la partie I), tout est clair... Et j'ai feuilleté mon livre de chimie, et j'ai bien compris la configuration éléctronique....
Pourrais-tu m'aider pour les II) et III)
Merci encore!
C'est assez compliqué d'expliquer les représentations de Lewis sans pouvoir faire de schéma...
En gros la méthode c'est:
1) Faire la somme des électrons des couches externes apportés par tous les atomes de la molécule.
2) En déduire le nombre de doublets en divisant par 2
3) Répartir les doublets entre les atomes (doublets liants) et autour des atomes (doublets non liants) de façon à ce que les atomes respectent la règle du duet (pour l'hydrogène) et de l'octet pour les autres.
exemple: molécule NH3
N a 5 électrons de valence (sur la couche externe), et H 1 électron.
Ca fait donc en tout 8 électrons.
Il vont former 8/2 = 4 doublets. Il faut maintenant les répartir:
H
|
|N - H
|
H
On a bien les H entourés de 2 électrons (=1 doublet) et N entouré de 8 électrons (4 doublets)
Sinon, je vois quon te demande de donner la représentation de Lewis d'un atome, (ce que je trouve assez étrange mais passons...)
Il faut de la meme manière compter les électrons de la couche externe, et placer les doublets autour de l'atome. Pour le soufre (6 électrons sur la couche externe) ça donnerait:
/
< S
\
(le chapeau, c'est deux doublets)
Je te laisse essayer de représenter les autres molécules, si tu as besoin d'aide dis moi, mais c'est assez compliqué de dessiner les molécules ici 
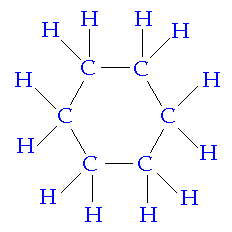
La molécule est cyclique si elle présente... un cycle. (éclairant n'est-ce pas...)
Par exemple, le cyclohexane est cyclique (voir image):
Tu te rendras compte quand tu essayeras de représenter l'octasoufre, que tu es obligé de former un cycle pour respecter la règle de l'octet.
Deuxième indication: pour l'acide éthanoïque, il y a une liaison double C = O