Inscription / Connexion Nouveau Sujet
Etudier des solides ioniques / solutions électrolytiques
Bonjour,
Voilà j'ai deux petits exercices à faire,
je les ai faits mais je ne suis pas sur de moi.
Exercice 1 : Fluorure de plomb
(j'ai utilisé ici une image identique trouvée sur wikipédia)
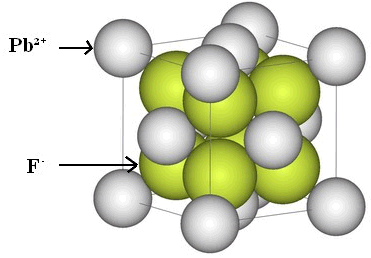
1. Comment peut-on expliquer la disposition régulière des ions de cet édifices ?
2. Ce solide est-il conducteur du courant électrique ?
3. Quelle est sa formule statistique ?
Mes réponses
1. Un ion Pb2+ positif est attiré par deux ions F- négatifs qui l'entourent. De même, l'ion F- est attiré par deux ions Pb2+ qui l'entourent.
Les interactions électriques entre les ions assurent la cohésion de cet assemblage.
2. Oui, ce solide est conducteur du courant électrique.
Mais comment le démontrer ?
3. Un ion Pb2+porteur de deux charges positives doit être accompagné de deux ions florure F-, porteurs chacun d'une seule charge négative.
La formule statistique du fluorure de plomb est PbF2.
Exercice 2 : Coussis chauffants et refroidissants
Les coussins chauffants ou refroidissants servent au traitement des blessures que subissent les athlètes. Ils contiennent une poche d'eau et une espèce chimique ionique solide. Si on tord le sac, la poche d'eau se rompt et le solide se dissout. La solution devient alors chaude ou froide suivant la nature du solide. Les coussins chauffants contiennent du sulfate de magnésium, alors que les coussins refroidissants contiennent du nitrate d'ammonium.
1. Le magnésium appartient à la deuxième colonne de la Classification périodique. Ecrire la formule statistique du sulfate de magnésium.
2. La formule de l'ion ammonium est NH4+. Quelle est la formule statistique du nitrate d'ammonium ?
3. Ecrire les équations de dissolution des solides dans l'eau.
Mes réponses
1. La formule statistique du sulfate de magnésium est MgSO4.
2. La formule statistique du nitrate d'ammonium est NH4NO3.
3.
MgSO4 eau > Mg2+(aq) + SO42-(aq)
NH4NO3 eau > NH4+(aq) + NO3-(aq)
Voilà dites-moi ce que vous en pensez, ce qu'il faut corriger et aussi rédiger car je ne sais pas si c'est la bonne manière.
Et aidez-moi pour la question 2. de l'exercice 1, je ne sais pas comment prouver que ce solide est conducteur du courant électrique.
Merci d'avance ! 
édit Océane : image placée sur le serveur de l'
Bonsoir!
1. Un ion Pb2+ positif est attiré par deux ions F- négatifs qui l'entourent. De même, l'ion F- est attiré par deux ions Pb2+ qui l'entourent.
Les interactions électriques entre les ions assurent la cohésion de cet assemblage.

Tu peux étoffer un peu plus si tu désires:
Un cristal ionique est constitué d'un assemblage de cations et anions. Les ions occupent des positions sensiblemnt fixes qui constituent une structure géométrique ordonnée: le réseau cristallin.
J'avais écrit ça à une autre personne (j'étais inspirée ce jour là):
dans un cristal ionique, les attractions entre un ion et ses plus proches voisins, de charge opposée à la sienne, sont assurées par les intéractions coulombiennes. Ces attractions étant plus fortes que les répulsions, entre ions de même signe, le cristal est stable.
2. Oui, ce solide est conducteur du courant électrique.
Mais comment le démontrer ?
Tout simplement car il est constitué d'ions... Par définition, un ion en solution conduit le courant électrique. L'eau est un solvant dissociant, or ce cristal est un solide ionique donc tu vas assister à une solvatation des ions.
3. Un ion Pb2+porteur de deux charges positives doit être accompagné de deux ions florure F-, porteurs chacun d'une seule charge négative.
La formule statistique du fluorure de plomb est PbF2.
C'est parfait
 Rien à dire.
Rien à dire.1. La formule statistique du sulfate de magnésium est MgSO4.
Oui, justifie
2. La formule statistique du nitrate d'ammonium est NH4NO3.
ok là c'est bon...
MgSO4 eau > Mg2+(aq) + SO42-(aq)
NH4NO3 eau > NH4+(aq) + NO3-(aq)
Mets un petit (s) de la même manière que (aq) derrière
NH4NO3 et MgSO4.
Tu n'as pas vraiment besoin de mettre eau au-desus des flèches maisc'est vrai que pour la rigueur c'est mieux...
Tu as donc MgSO4(s)
 Mg2+(aq)+SO42-(aq)
Mg2+(aq)+SO42-(aq)
c'est parfait.
Et NH4NO3(s)
 NH4+(aq)+NO3-(aq)
NH4+(aq)+NO3-(aq)
Là aussi c'était nickel...
Voila

Autre chose?
Merci beaucoup shadowmiko !!
Tout est bon maintenant, je peux recopier au rpopre maintenant. 
Encore merci et à bientôt !
Ah ok je me demandai pourquoi j'avais reçu un message c'est simplement Océane qui a placé l'image sur le serveur de l'île...
Euh, je viens glisser mon petit grain de sel, mais, un solide ionique est isolant je pense, vu qu'il n'y a pas d'électrons libre, non ?
J'ai relu, pourtant le solide n'étant pas en solution, il est donc isolant? Biensur en solution, la présence d'ions est suffisante pour dire qu'il y a courant, non ? Mais ici, le solide ionique est isolant.
Le solide en lui-même oui, puisque c'est un édifice chimique électriquement neutre... Après il ne l'est pas parfaitement
Un solide ionique est un édifice chimique électriquement neutre. Théoriquement, il conduit très peu le courant (un peu qd même à cause de certains électrons épris de liberté ). Une fois mis en solution, il se dissout en ions. Tu obtiens une solution électrolytique et dc ionique. Elle conduit par csqt le courant
). Une fois mis en solution, il se dissout en ions. Tu obtiens une solution électrolytique et dc ionique. Elle conduit par csqt le courant
Pas de probleme, la je suis d'accord avec toi ^^. Mais c'est parce que dans l'exo, question 2, il a répondu oui, alors que le solide en lui meme est isolant.




