Inscription / Connexion Nouveau Sujet
Équation d'équilibre et tableau d'avancement
Bonsoir.
Tout d'abord je tiens à m'excuser de poster autant en ce moment mais je suis en pleine révision, j'essaie de ne pas exagérer pour autant !
Je me pose une question et je sais qu'il faut vraiment que je maîtrise le tableau d'avancement surtout à ce stade mais j'ai du louper quelque chose... Je m'explique :
Je révise en ce moment les réactions à l'équilibre et j'ai l'exercice suivant " Soit l'équation . Au départ l'on a 2 moles par litres de A . A l'équilibre on trouve 1 mole par litre de la même substance. Sachant que Kc = 16 calculer les concentrations à l'état d'équilibre de B et de C.
Dans d'autres cas j'ai toujours jusqu'à présent utilisé le tableau d'avancement et je me permets donc de joindre celui que j'ai établit pour cet exercice (ce sera plus évident pour voir si et où j'ai fait une erreur...)
Dans le cours l'on est censé trouvé 0,25 pour la concentration de B , et je trouve 1,25.
Merci beaucoup d'avance, bonne soirée
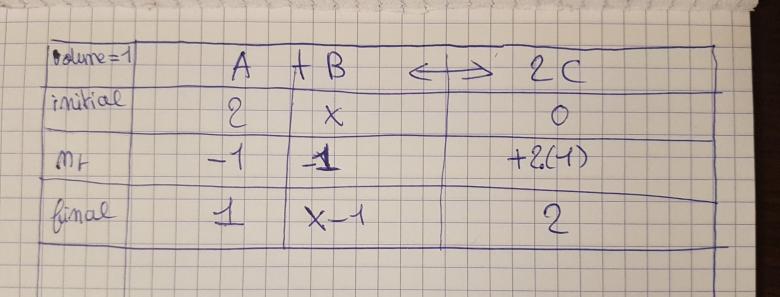
D'après ton tableau d'avancement :
[B]eq = X-1
On a :
2² / (X-1) = 16
16 (X-1) = 4
X-1 = 0,25
Donc [B]eq = 0,25 mol/L
Ton résultat de 1,25 mol/L correspond à la concentration en B à l'état initial, mais l'énoncé demande cette concentration à l'équilibre.


