Inscription / Connexion Nouveau Sujet
Energie Interne
Bonsoir,
J'ai un DM à faire et je rencontre des difficultés à trouver les différentes étapes du raisonnement, pouvez-vous m'aider ? 
Enoncé:
Thierry s'est fait couler un bain de 150 L. Malheureusement, au moment de rentrer dedans, il s se rend compte qu'il est trop chaud, il est en fait à 45°C et il le voudrait à 37°C. Combien d'eau froide du robinet (à 17°C) doit-il verser pour qu'il soit à la bonne température ?
Données annexes:
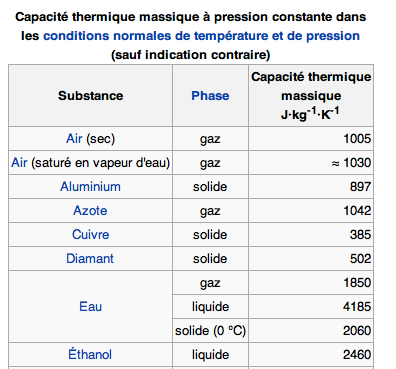
bonsoir,
tu considères les deux masses d'eau mélangées:
- la masse d'eau chaude (volume: 150 L)
- la masse d'eau froide (volume V à déterminer)
que se passe-t-il physiquement lors du mélange?
sais-tu calculer la quantité de chaleur échangée par chacune des masses d'eau lors du mélange?
Lors du mélange, de l'énergie est libérée par transfert thermique.
Et non je n'ai pas appris à calculer des quantités de chaleur échangées par des masses d'eau lors d'un mélange ... Comment faire autrement ?
tu as dû avoir un cours de calorimétrie, non?
et tu dois connaître une relation entre la quantité de chaleur échangée par un corps et la différence de température de ce corps
Ah si je connais la formule de la capacité calorifique massique: c=( U)/(m*
U)/(m* T)
T)
Ce sont égalements les données dans le tableau.
Mais un calorimètre est un système fermé, or ici le système étudié est la baignoire donc où est la cohérence ?
effectivement la baignoire n'est pas vraiment un calorimètre,
mais ici on suppose que durant le mélange les deux masses d'eau n'échangent de la chaleur qu'entre elles (càd qu'on néglige les autres échanges, par ex. avec l'air ou avec la baignoire)
D'accord je comprends.
Mais en fait j'ai les données suivantes:
Vi= 150L
Ti= 45°C
Vf= ??
Tf= 37°C
ceau= 4185 J.Kg-1.k-1
et quelles sont donc les étapes de calculs pour à la fin trouver le volume d'eau froide nécessaire pour avoir une température de 37°c ?
tu as deux masses d'eau à considérer
a) les 150 L d'eau chaude qui perdent une quantité de chaleur Q1 (l'eau chaude se refroidit)
b) la masse d'eau froide (de volume V à trouver) qui elle se réchauffe en absorbant une quantité de chaleur Q2
tu sais calculer
Q1
Q2 (en fct de V)
et tu sais aussi que Q1 + Q2 = 0 (puisqu'on suppose que durant le mélange, le contenu de la baignoire est isolé)
cela te donne finalement V
Q1 = m*c
Est-ce faux de dire que 1kg=1L ?
Dans ce cas:
Q1= V*c
Q1= 150* 4185
Q1= 627750 J
Comme Q1=Q2
Alors Q2= m*c
Q2= V*c
V= Q2/c
V= 627750/4185
V= 150L
En fait là je tourne en rond, et je n'inclue pas la température ...:S
attention!
Q = mC(Tf - Ti)
donc Q1 = ... (pour l'eau chaude)
Q2 = ... (pour l'eau froide)
et comme Q1+Q2=0 on trouve V
Q = mC(Tf - Ti)
avec Ti: température initiale et Tf: température finale du système considéré
donc Q1 = 150*4185* (37-45)
Q1<0 car la masse d'eau chaude cède de la chaleur
Donc pour Q1 je trouve -5022000 J, c'est bien ça ?
Et pour Q2 il faut faire:
Comme Q1+Q2=0
Alors Q1=-Q2
Donc Q2= -[Vf*4185*(37-45)
Q2= -(Vf*(-33480)
-5022000=-Vf*33480
-150=-Vf
Vf= 150
Donc il faut verser la même quantité d'eau froide dans l'eau chaude ?? je ne trouve pas ça très cohérent ...
Q2=m*c*(Tf-Ti)
Q2= 4185*Vf*(37-17)
Comme Q1=Q2 Alors Q2=-Q1
Donc -(-5022000)=83700*Vf
Vf= 5022000/83700=60L
C'est ça ? 
oui, mais en toute rigueur il faut écrire
Q2 = 4185  eau Vf (37-17)
eau Vf (37-17)
car c'est la masse d'eau dans la formule, pas le volume
mais comme  eau = 1 kg/L puisque l'on exprime les volumes en litres
eau = 1 kg/L puisque l'on exprime les volumes en litres
ça ne change rien



