Inscription / Connexion Nouveau Sujet
électrolyse
Bonjour !
On souhaite déposer une masse de 0,12kg de zinc sur une pièce d'acier, pour cela, on réalise un électrolyse à anode consommable d'une solution ZnCl2. La pièce en acier constitue la cathode et le zinc l'anode.
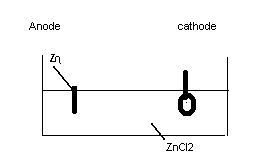
a.) donner le schéma de principe de cette électrolyse : ==> image en bas
Ecrire les demi-réactions et l'équation bilan . Quelle est la tension théorique minimale ?
(oxydation) Zn-2é --> Zn2+
(réduction) Zn2++2é --> Zn
équation bilan Zn + Zn 2+ --> Zn2++Zn
La tension théorique minimale est de 0V.
b.)Déterminer l'intensité I du courant d'électrolyse pour obtenir une masse m de dépôt métallique en une durée de 10 h.
m= 120g et t= 36'000 sec F=96500
Q=I.t et Q= né.F
né=3,67 moles d'électrons donc Q = 3,67 x 96500 = 354155 C
==> I = Q/t = 9,84 A
c.) La concentration massique en ZnCl2 de la solution initiale est de 70 g/l. Quelle est la concentration finale de cette solution ?
Est-ce que quelqu'un pourrait me corriger la a.) et b.) et m'expliquer comment trouver la concentration finale pour la c.) ?
Merci d'avance,
Steph 
On sait que Zn-2é --> Zn2+
nZn=m/MM=120/65,7=1,83 moles
On sait qu'une mole de Zn = 2 moles d'é ==> 1,83 moles de Zn = 3,67 moles d'électrons
c'est juste?




