Inscription / Connexion Nouveau Sujet
Eexercice sur les dosages
Bonsoir je dois réaliser pour demain un exercice mais j'ai quelques difficultés : voici l'énoncé :
On doit doser par conductimétrie de l'ammoniaque avec de l'acide chlorhydrique de concentration 0,50mol/l.
1)Pourquoi a t'on dilué la solution d'acide chlorhydrique ? ( je ne sais pas pourquoi )
2) On prélève ensuite 20ml d'acide chlorhydrique que l'on verse dans le bêcher, on ajoute 50ml d'eau distillée,puis on verse,à l'aide d'une burette,l'ammoniaque.
Il faut écrire l'équation de la réaction , ce qui me pose problème:
je connais le couple de l'ammoniaque qui est :
NH4+ / NH3 ( ici NH3 est la base et est l'un des réactifs ) cependant quel est le couple pour l'acide chlorhydrique, pourriez vous m'aider à réaliser cette équation?
NH3 + H3O+ CL- (spectateur) => NH4 + H2O
est ce cela ?
Enfin il faut calculer la concentration molaire de la solution d'ammoniaque.
après avoir fait un tableau d'avancement j'ai fais C1V1= C2V2
C1V1 pour l'ammoniaque et C2V2 pour l'acide chlorhydrique , en remplaçant
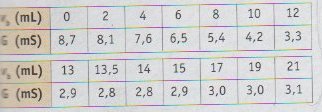
pour les valeurs je trouve C1 = (o,5 x 0,02)/0,01375 en effet dans le tableau ci joint l'équivalence semble être pour un volume entre 13,5 et 14 mL.
je trouve donc C1=0,76 mol/L .
est ce cela ?
Merci beaucoup
Merci beaucoup
Pour la 1, on dilue la solution d'acide chlorhydrique car il est trop concentré (0.5 mol/L)
Avec une telle concentration on ne peut effectuer le titrage.
2) Nh4+ = NH3 + H+
H30+ = H20 + H+
___________________
NH3 + H30+ = NH4+ + H20
(pas besoin de Cl-)
Pour la dernière question, tu n'avais pas un graphe a tracer en essayant de trouver Veq avec la méthode des tangentes parallèles ?
Sinon ton raisonnement me semble correct.
Sauf erreur de ma part, je pense que c'est ça.
Bonne soirée.
merci , de même avec cette exercice, il y avait quelques petites question annexes auxquelles je ne sais pas répondre , pourriez vous m'aider ... s'il vous plait
_> on nous demande pourquoi l'on a dilué la solution d'acide chlorhydrique ?


