Inscription / Connexion Nouveau Sujet
eau oxygénée
Bonsoir, pourriez vous m'aider à faire et surtout à comprendre cet exo (de DM)?
L'eau oxygénée est une solution aqueuse de péroxyde d'hydrogène H2O2, ayant des propriétés blanchissantes et disinfectantes. Les solutions se dégradent progressivement suivant une réaction de dismutation, produisant du dioxygène et de l'eau. Sur les flacons d'eau oxygénée à sa disposition, René voit écrit "eau oxygénée à 110 volumes", ce qui signifie qu'un litre de solution donnerait si la dismutation était complète 110 litres de dioxygène. Le volume molaire des gaz dans les conditions normales est Vm= 25L/mol
a)Déterminer la formule de Lewis du péroxyde d'hydrogène.
b)Déterminer la concentration molaire de la solution d'eau oxygénée.
c)René veut diluer cette solution pour en obtenr une vingt fois moins concentrée. Décrire un protocole experimental précis et chiffré permettant de réaliser cette opération
comment faire pour la b)?
pour la c) je ne sais pas du tout sur quoi me baser..
merci
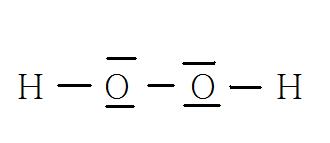
Salut !
!
a) TB
b)
qu'un litre de solution donnerait si la dismutation était complète 110 litres de dioxygène
c) Tu as le facteur de dilution. Tu utilises le résultat de la b) que tu divises par 20.
Ensuite protocole classique de dilution en précisant bien la verrerie utilisée
shadowmiko!
b) je n'arrive pas à en déduire quelquechose..
c)"Ensuite protocole classique de dilution en précisant bien la verrerie utilisée"
je n'ai jamais exactement compris comment choisir la verrerie..
"Ensuite protocole classique de dilution" ?
b) tu produis 110 L de dioxygène à 25 L/mol, ce qui te donne n.
Ensuite tu peux faire un tableau d'avancement si ça t'arrange
c) Ah... Faisons d'abord la b)
b)n(O2)= V(O2)/Vm = 110/25 = 4,4 mol
ensuite il faut faire un tableau d'avancement "à l'envers" c'est cela?

pour faire le tableau d'avancement il faut écrire l'équation de réaction mais je n'arrive pas à l'équilibrer
H2O2 O2 + H2O
O2 + H2O
à cause des O..

ha ok je crois avoir compris
on trouve donc la quantité de matière de la solution d'eau oxygénée n(H2O2)-2 X 4,4=0 donc n = 8,8 mol et on poursuit avec c(H2O2)= 8,8/1L = 8,8mol/L mais là j'ai pris Volume = 1L car on a pas le volume, est cça qu'il faut faire?
merci
c)René veut diluer cette solution pour en obtenir une vingt fois moins concentrée. Décrire un protocole experimental précis et chiffré permettant de réaliser cette opération
quelle verrerie utilisée? et comment choisir la graduation (et pourquoi)? Mon prof n'a pas beaucoup insisté sur ce point l'année dernière... merci de m'expliquer 

d'accord mais à quoi servira chacun de ces outils et comment déterminer leur volume?
merci de m'avoir répondu 
La verrerie jaugée est tjs plus précise.
Je te conseille de rechercher sur internet pour avoir les schématisations et tout le bazar
oui mais le volume de la pipette, de la burette et des béchers d'étbli en fonction des volume trouvés avant dans l'exercice non?
une dilution c'est quand on rajoute de l'eau c'est cela?
il faut préciser si on choisit un bécher de 50mL ou de 25mL et je pense que la choix de ces volumes dépend de ce dont on a besoin, et ce dont on a besoin on le déduit des résulats trouvés au a) et au b)..
on sait juste que le volume de la solution est d'1L..
pourquoi des pipettes et des burettes et des béchers? il suffit de rajouter de l'eau dans la solution et puis voilà .. mais il faut qu'elle soit 20 fois moins concentrée alors comment prendr een compte ceci?
Le mieux c'est de prélever un certain volume de ta solution, tu l'as places dans un bécher puis tu dilues
si je prélève 0,25L de la solution d'un L c'est trop? pas assez? Je mets ces 0,25L= 250mL dans un bécher de combien ? A quoi servent la fiole jaugée et la burette?
Il faut que tu puisses diluer ton volume 20 fois. Si tu prends une fiole jaugée de 100 mL par exemple, tu dois prendre 5 mL de ta solution
donc je prélève 5mL de la solution d'eau oxygénée avec -quelle verrerie chiffrée?- que je mets dans une fiole jaugée (pourquoi une fiole jaugée?) de 100mL, et ensuite, que fais je? je rajoute 20 fois 5mL d'eau? pourquoi 5mL? et avec une pipette de combien?
thanks (à prononcer "tanqse"^^)
Tu prélèves avec une pipette jaugée de 5 mL
Tu les mets dans une fiole jaugée de 100 mL (jaugée car + précise)
Tu complètes avec de l'eau: tu remplis aux 3/4 avec une pisette puis tu termines au compte-goutte
Tu finis en bougeant la fiole et en homogénéisant la solution
C'est prêt, à table (ou pas...)
dac c'est très clair mais comment sais tu qu'en faisant ce protocole, tu dulies 20 fois?

(moi je ne viens surement pas à table !)
Tu n'as pas besoin de faire remonter ton topic à chaque fois si tu sais que l'intervenant va revenir. Si je dois m'absenter, je m'arrange pour que qqn prenne ma suite
le facteur de dilution c'est la concentration avant/concentration après
on a juste la concentration "avant" = 8,8 mol/L
PS:Je comprends mais j'imagine que les personnes qui m'aident m'oublies comme vous faites souvent plusieurs topics en même temps, ce serait normal 
Cependant sur mes topics "horizon" et "mécanique" personne n'est revenu 

Du moment que l'on t'a répondu, on a soient les signalements de réponse, soit on se sert de l'icone "vos messages postés" où l'on voit à la couleur du dossier et au "New" si on n'oublie personne
Mais c'est bien de penser à faire remonter aussi, ça n'était pas un reproche
facteur de dilution ok pour concentrations et en terme de volumes?
je ne sais pas pour les volumes..
PS: si vraiment personne ne répond à mes deux topics, pourras tu y jetter un coup d'oeil si tu as le temps et le courage (oui..c'est de la physique )?
)? 
F=Cm/Cf=Vf/Vm
avec Cm=concentration de la solution mère
Cf=concentration de la solution fille
Vf=Volume final de la solution fille
Vm=Volume de la solution mère à prélever
Cm=8,8mol/L
Cf=8,8/20=0,44 mol/L ?
Vf=75mL puisqu'on rempli jusqu'au 3/4 la fiolode jaugée de 100ml?
Vm=on a prelevé 5mL donc Vm=5mL?
dis moi si je me trompe 
Tu peux simplement dire que tu prends une fiole jaugée de 100 mL.
Tu as un facteur de dilution F = 20 (c'est l'énoncé tu es d'acc avec moi?).
Donc F = Vf/Vm d'où Vm = Vf/F = 100/20 = 5 mL
si Vf le volume final de la solution fille est 100mL cela veut dir qu'on a rempli la fiolode jaugée au 4/4 plutot qu'aux 3/4 comme on a dit précedemment non? alors je dis qu'on remplit la fioloe en entier? le 3/4 a de l'importance?

dacodac c'est ok
il faut à présent que je boucle les exos "mécanique" et "horizon" .. je peux le faire

 merci
merci 
 pour demain, I can do it
pour demain, I can do it 
