Inscription / Connexion Nouveau Sujet
Doser par étalonage
Bonjour, j'ai quelques exo mais j'arrive pas à faire. Pourriez vou m'aider en expliquant svp...
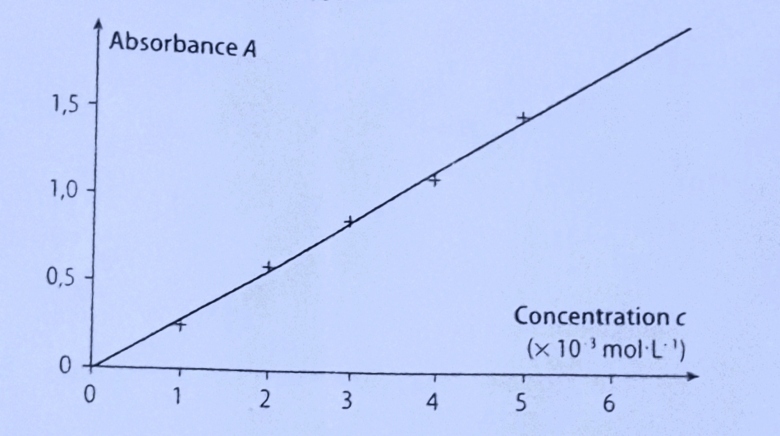
Pour doser par étalonnage colorimétrique le carotène dans une solution de concentration inconnue, on prépare une échelle de teintes de carotène. puis on mesure leurs absorbances A à 450 nm dans des cuves de longueur l= 1.0 cm. Le graphique d'étalonnage est représenté ci-dessous.
a) Ce graphique confirme-t-il que la loi de Beer- Lambert est vérifiée? Justifier.
[Je croyais si on obtient une droite qui passe par l'origine, c'est donc la loi verifié mais je trouve cette idée est trop simple, stupide et un peu bizzard... @@ ]
b) Utiliser ce graphique pour retrouver la valeur du coefficient d'absorption molaire à 450 nm.
c) Une solution de carotène de concentration inconnue a une absorbance A = 0,68 à 450 nm. A l'aide du graphique de l'exercice 25, en déduire sa concentration.
[ Pour le 25, on a longueur l du cuve = 1cm. On suppose que la loi de Beer-Lambert est vérifiée.
• Epsilon = 290 L/mol•cm à 450nm
- j'ai trouvé C = 1,55 mol/L
• Epsilon à 500nm, j'ai trouvé 322 L/mol•cm ]
d) Retrouver cette absorbance en utilisant le coefficient d'absorption molaire et la loi de Beer-Lambert.
Merci beaucoup.
Bonjour,
a. Il faudrait tout d'abord rappeler la loi de Beer-Lambert et son expression (en définissant bien tous les termes utilisés).
Ensuite, de cette loi, comme en mathématiques, tu es en mesure de déduire qu'il existe une relation de proportionnalité entre l'absorbance de la solution et sa concentration A = k x C avec k = constante = ...
b. Il faut calculer le coefficient directeur de la droite, qui n'est autre que k = ...
Puis par analogie avec la loi de Beer-Lambert, tu est en mesure de dire que k = ...
donc ...
c. Un peu plus d'explications dans ce que tu fais ne ferait pas de mal ...
d. Utiliser la relation établie en question a et la valeur calculée en b.