Inscription / Connexion Nouveau Sujet
Dosage conductimetrique d'une solution de detartrant pour WC
I) 1) Rappelez la formule d'une solution d'acide chlorhydrique puis d'une solution de soude.
Réponse:La formule d'une solution d'acide chlorhydrique: H3O+ + Cl-
La formule d'une solution de soude est: OH- + Na+
2) Indiquez quelles sont ces espèces et précisez les couples acide-base mis en jeu.
Réponse: H3O+/H2O
H2O/OH-
3)Écrivez les demi équations formelles correspondant à ces couples, puis l'équation de la réaction qui modélise la transformation étudiée.
Réponse: H3O+ = H2O + H+
H2O= OH- + H+
2H2O = H3O+ + OH-
II) 1) On donne les conductivités ionique molaires de quelques ions à la température de 25°C:
delta NA+ = 5.01mS.m².mol delta Cl-= 7,63 mS.m².mol delta H3O+ = 35,0 mS.m².mol delta OH = 19,9 mS.m².mol
a) Expliquez pourquoi la conductivité de la solution commence par diminuer, bien qu'on apporte des ions dans la solution. Réponse: La conductivité de la solution commence par diminuer car on ajoute du Na+ +OH- c'est sa?
b) Quel est le réactif limitant?
2) a) Expliquez pourquoi au-delà d'un certain volume V2 de la solution de soude versée, la conductivité de la solution augmente.
b) Quel est le réactif limitant?
3) a) Expliquez pourquoi le volume V2 pour lequel la conductivité est extremum permet de repérer l'équivalence.
b) Déterminez V2 avec précision. (V1= 10,0mL, C2= 1,0x10 puissance -1 mol.L et C1= C/20 et la concentration de C on la diluer 20 fois pour obtenir 200mL )
SVP aidez moi
Bonsoir,
I. 1. TB
2. Oui !
3. TB
sauf qu'il faut mieux écrire :
H3O+ = H2O + H+
OH- + H+ = H2O
___________________
H3O+ + OH- = 2H2O (les réactifs à gauche)

II.
1. L'équation de la réaction est H3O+ + OH- = 2H2O
La conductivité de la solution s'écrit
 =
=  (Na+).[Na+] +
(Na+).[Na+] +  (Cl-).[Cl-] +
(Cl-).[Cl-] +  (H3O+).[H3O+] +
(H3O+).[H3O+] +  (OH-).[OH-]
(OH-).[OH-]
admettons qu'on verse la soude dans un bécher contenant l'acide,
les ions OH- versés réagissent avec les H3O+ du bécher
donc dans le bécher :
[H3O+] diminue
[OH-]  0 mol/L
0 mol/L
[Cl-] = cste car ions spectateur dans le bécher
[Na+] augmente
donc ici OH- est le réactif limitant et  tend à diminuer.
tend à diminuer.
2. A l'équivalence, on a versé un volume V2 de soude, tous les H3O+ du bécher ont réagi donc [H3O+] 0 mol/L et [OH-]
0 mol/L et [OH-] 0 mol/L (bien sûr, [Cl-] = cste et [Na+] augmente.
0 mol/L (bien sûr, [Cl-] = cste et [Na+] augmente.
H3O+ est alors le réactif limitant.
La conductivité est alors minimale.
Après l'équivalence, il n'y a plus de H3O+ donc les nouveaux OH- versés ne réagissent pas. Ainsi,
[OH-] et [Na+] augmentent
[Cl-] = cste
[H3O+] 0 mol/L
0 mol/L
la conductivité tend à augmenter.
Bilan :
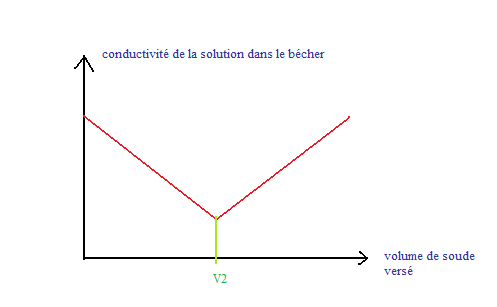

D'accord merci beaucoup de ton aide  .
.
je voulais savoir comment calculez V2? car j'ai un autre exercice qui suit et il me demande des calcul avec V2 donc je ne pourrai pas continuer si je ne l'ai pas.
Non excuse moi, je n'ai rien dit, j'ai mon volume de V2 sur la courbe  .
.
Mais je voudrai savoir si mes reponse pour aprs son les bonnes.
I)1) Exprimez la quantté de matière initiale des ions H3O+ en fonction du volume V1 et de la concentration C1. (V1= 0,100L et C1= C/20)
Réponse: n(H3O+)= C1.V1
2) Eprimer la quantité de matière initiale des ions HO- apportés en fonction du Volume V2 et de la concentration C2.
Réponse:n(HO-)= C2.V2
3) C'est un tableau qui faut remplir literralement donc sa c'est bon.
II) 1)Rappelez comment on définit lasituation d'équivalence.
Réponse: Il y a équivalence lorsque les réacifs ont été mélangés dans les proportions stoechimetriques définies par les coefficiets de la réaction.
2) Dans l'état final, quelle est l quantité de chacun des réactifs en solution à l'équivalence?
Réponse: Stochiométrique.
3) En déduire 2 expressions de l'avancment maximum xmax: l'une en fonction de C1, V1 et l'autre en fonction de C2 et V2.
Réponse: C1.V1-a.xmax=0 donc xmax= C1.V1/a
C2.V2-b.xmax=0 donc xmax= C2.V2/b
Alors C1.V1/a = C2.V2/b
4) En déduire la relation qui lie la concentration C1 ,V1,C2 et V2.
Réponse: C1/C2 = V2/V1 = F
III) 1) Calculez la concentration C1 de la solution S1.
Réponse: C1=C2.V2/V1 donc C1= 1,0x10puissance-1 x 0,100/ 0,100
=1,0 x10 puissance-1 mol/L.
2) Calculez la concentration C de la solution comerciale S0 de détartrant.
Réponse: C1=C/20 donc C= C1 x 20 C= 1,0 x10puissance-1 x 20 =2 mol/L.
IV) 1) A l'aide d'une balance déterminez la masse de 100mL de solution commerciale S0.
2) En déduire la masse de 1,00litre de cette solution.
I. 1. TB
2. Exact !
3. Je te fais confiance 
II. 1. Oui
2. Oui
3. La méthode est correct mais pourquoi as-tu laissé des coefficients a et b pour la relation ?
Je te rappelle que l'équation de la réaction du dosage est H3O+ + OH- = 2H2O
donc à l'équivalence ni(H3O+) dans V1 /1 = ni(OH-) dans V2 /1
<=> C1.V1 = C2.V2
(i pour initiale)
4. En fait, pour la question 3. il fallait juste écrire xmax = C1.V1 et xmax = C2.V2
donc C1.V1 = C2.V2
III. 1. Oui TB !
Si C2 = 0,100 mol/L
V2 = 0,100 L
V1 = 0,100 L
alors ton application numérique est correcte.
2. Exact !
IV. Pourquoi s'arrêter en si bon chemin ?

D'accord merci d'avoir verifier.
Je me suis arrêter en si bon chemin car la prof a oublier de nous donner une donnée pour le faire en entier, donc voila, et puis aujourdhui elle ne me l'a pas ramassé  .
.
Merci beaucoup de ton aide.


