Inscription / Connexion Nouveau Sujet
dosage conductimétrique
Bonjour!
J'ai un exercice de chimie sur un dosage acide faible / base forte. Je n'ai pas encore étudié ce cas en cours, je n'ai pour l'instant travaillé que sur des dosages acides forts / bases fortes. Dans cet exercice la courbe me parait très étrange et j'ai eu beau regarder sur internet je n'ai rien trouvé qui puisse m'aider à l'interpréter. Voici l'exercice:
On souhaite déterminer à l'aide d'un titrage colorimétrique puis d'un titrage conductimétrique la concentration CA d'acide acétique de formule CH3COOH.
Titrage colorimétrique: On titre un volume VA= 20 mL de solution A à l'aide d'une solution de soude de concentration CB= 50mmol/L en présence de rouge de crésol. Le changement de teinte a lieu pour un volume VbE= 13,6mL.
-Ecrire l'équation de réaction du titrage:
CH3COOH + HO-  CH3COO- + H2O
CH3COO- + H2O
-Déterminer CA:
CA = 0,034mol/L
Titrage conductimétrique:
On prélève un volume V'A=100mL de la solution A et on dose à l'aide d'une solution de soude de concentration C'B=0,400mol/L.
| Vb | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 18 |
 (S/m) (S/m) | 0,3 | 0,75 | 0,15 | 0,2 | 0,28 | 0,4 | 0,57 | 0,75 | 1,05 |
-Tracer la courbe en vous aidant du tableau: C'est à partir d'ici que je suis paumée!

-Déterminer le volume de solution de soude nécessaire pour atteindre l'équivalence: je n'arrive pas à localiser l'équivalence sur la courbe...
-Quelles sont les espèces ioniques présentes dans la solution avant puis après l'équivalence? : J'ai mis un peu au hasard: -avant CH3COO- et Na+
-après Na+ et HO-
-Comment évoluent leurs concentrations lorsqu'on ajoute la solution de soude? Comment peut on interpréter l'évolution de la conductivité avant puis après l'équivalence?
Et voilà! Maintenant pouvez vous m'aider?

Bonsoir,
-Tracer la courbe en vous aidant du tableau
Quelque type de courbe obtiens-tu ? Schéma avec paint ?
-Déterminer le volume de solution de soude nécessaire pour atteindre l'équivalence
Normalement tu as deux droites de pentes différentes. Leur intersection donne le volume équivalent (en abscisse).
-Quelles sont les espèces ioniques présentes dans la solution avant puis après l'équivalence?
Interprète l'équation-bilan ...
CH3COOH + HO- CH3COO- + H2O
Avant l'équivalence : il y a du CH3COOH qui n'a pas encore réagi avec la soude versée et Na+.
A l'équivalence, tout le CH3COOH a réagi. Il y a toujours les Na+ qui sont spectateurs, donc leur concentration continue d'augmenter.
Après l'équivalence, il n'y a plus de CH3COOH donc il y aura des OH- et Na+.
Dans chaque cas, il y a bien évidemment de l'eau mais ce n'est pas nécessaire de le préciser.

Voilà la courbe que j'obtiens. Elle ne correspond pas avec les autres courbes de dosages acide faible base forte qu'il y a sur internet.
Pour les espèces ioniques il n'y a pas de CH3COO- avant l'équivalence?
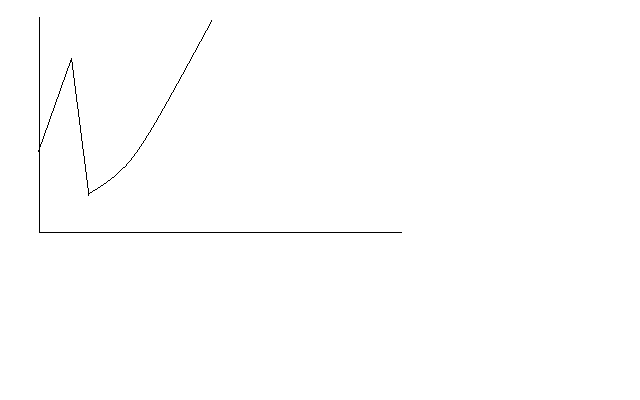
Pour les espèces ioniques il n'y a pas de CH3COO- avant l'équivalence?
en effet, je les ai oublié => TB

A mon humble avis, ce doit être ça :

Ok. Comment ça se fait que la courbe monte brusquement au début?
Sinon j'ai surtout un problème au niveau des concentrations à la dernière question... ce n'est pas très clair. Faut il que je les calcule ou juste que je dise comment elles évoluent, sans valeurs numériques?


