Inscription / Connexion Nouveau Sujet
Dosage acide ascorbique
Bonjour, j'ai un exercice de physique que je n'arrive pas à résoudre. j'aimerais que quelqu'un m'aide. Merci
Exercice :
On cherche a retrouver la teneur en acide ascorbique d'un comprimé de "Larascorbine 500" vendu en pharmacie. L'acide ascorbique sera représenté par la formule simple HA. Le dosage s'effectue en deux etapes.
1. Dosage de la soude utilisée par une solution d'acide chlorydrique
Pour arriver à l'équivalence, il faut verser dans 10 mL de la soution acide de concentration 2.00x10-2 mol.L-1, 10,2 mL de la solution de soude.
Determiner la concentration molaire Cb de la solution de soude.
2. Dosage de l'acide ascorbique par la solution de soude étalonnée
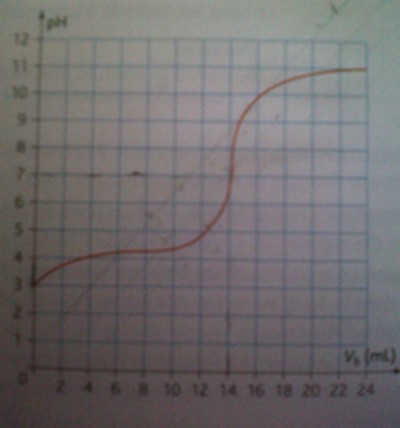
Un comprimé de "Larascorbine 500" est dissous dans de l'eau distillée, le volume de la solution etant égal à 200 mL. On preleve 200 mL de cette solution et on les dose avec la solution de soude. On suit au pH-mètre l'évolution du pH de la solution au fur et à mesure de l'addition de soude. La courbe obtenue est représentée ci-contre.
A.En déduire la concentration molaire de l'acide ascorbique dans la solution
B. En déduire la masse d'acide contenue dans un comprimé
C. Justifier l'appellation 500
D. Quelle est la valeur du Pka du couple acide ascorbique/ion ascorbate ?
Merci pour votre aide d'avance !
dans les 2 cas ,il s'agit d'une réaction d'un monoacide avec une monobase.
A l'équivalence
1)Ca*Va(eq)= Cb*Vb on en déduit Cb
2)Au n° 2 ,je pense qu'on prélève 20mL de solution ,dans les 200 préparés.
Ca*Va= Cb*Vb(eq)
Vb(eq) se détermine graphiquement
on en déduit Ca .
On calcule n(acide) dans 200mL puis m(acide)= n(acide)*M(acide)
On trouve environ 500mg .D'où l'appelation "Larascorbine 500"
le pKa est le pH à la demi- équivalence ,c'est à dire quand on a versé V(b)=vb(eq)/2
Merci à vous pour votre réponse.
Mais pour la question 1, j'ai cette formule mais je ne vois pas quelles sont les valeurs de Ca, Va et Vb. J'ai toujours eu ces données données dans l'énoncé.
bonsoir,
j'ai lu un peu vite ....
Le volume versé pour atteindre l'équivalence est celui de la soude.
On aura donc la relation
Ca*Va=Cb*Cb(eq)
Ca,Va,Vb(eq) sont donnés dans l'énoncé
Ca=2,00.10-2 mol/L
Va=10 mL
Vb(eq)=10,2 mL
L'inconnue est Cb
Merci pour cette réponse 
Donc, pour calculer n(acide) je prends la formule n=C.V et je le C trouvé à la question 1 ? Et V=200 mL ?
Ah non, je me corrige, il faut prend le C de la question a dans le 2/ , mais comment puis-je faire pour calculer cette concentration ?
bonjour,
1)Cb=Ca*Va/Vb(eq)= 2,00.10-2*10/10,2=1,96.10-2mol/L
remarque: le volume Va n'est donné qu'avec 2 chiffres significatifs.
Le résultat de Cb ne doit comporter que 2 chiffres significatifs ,soit Cb=2,0.10-2mol/L
2)
Un comprimé de "Larascorbine 500" est dissous dans de l'eau distillée, le volume de la solution etant égal à 200 mL. On preleve 200 mL de cette solution
je pense qu'on prélève 20mL dans 200mL.
On a donc
Cb=2,0.10-2mol/L
Vb(eq)=14 mL (d'après la courbe)
Va =20 mL (et non 200mL)
Ca=Cb*Vb(eq)/Va= 2.0.10-2*14/20=1,4.10-2mol/L.
calculer ensuite n(acide asc) dans 200mL ,c'est à dire le volume dans lequel le comprimé a été dissous.
calculer la masse du comprimé dissous. m=n*M
on trouve 0,49 g soit environ 500mg
Merci encore pour cette réponse.
Pour le premier calcul, il ne faut pas transformer le 10.2 et 10 mL en litres ? Car le résultat est en mol.L?
je pense qu'on prélève 20mL dans 200mL.
On a donc
Cb=2,0.10-2mol/L
Vb(eq)=14 mL (d'après la courbe)
Va =20 mL (et non 200mL)
Ca=Cb*Vb(eq)/Va= 2.0.10-2*14/20=1,4.10-2mol/L.
Le 2,0.10-2 que vous avez pris, c'est celui donné dans l'énoncé ou celui trouvé dans la question 1 ?
Merci
Pour le premier calcul, il ne faut pas transformer le 10.2 et 10 mL en litres ? Car le résultat est en mol.L?
la conversion est inutile à condition de prendre la même unité de volume au numérateur et au dénominateur.
Va/Vb(eq) ,dans la même unité est un nombre sans dimension.
Dans ces conditions,le résultat de Ca*(Va/Vb(eq)) a l'unité de Ca (ici,mol/L)
Le 2,0.10-2 que vous avez pris, c'est celui donné dans l'énoncé ou celui trouvé dans la question 1 ?


