Inscription / Connexion Nouveau Sujet
dosage
Voici mon sujet ainsi que les questions :
j'ai fais la liste du matériel nécéssaire à la réalisation de ce dosage
Jai fais un schéma annoté du montage
Il s'agit d'un dosage conductimétrique
J'ai fais le tableau d'avencement avec pour équation :H3O++ HO- 2H2O
2H2O
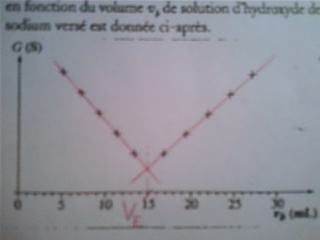
j'ai défini l'équivalence avec le graphique j'ai trouvé Ve=15 mL
Vb=Ve
a l'equivalence
Ca.Va=Cb.Vb
Ca=(CbxVe)/Va=7,5.10-2mol.L-1
na=Ca.Va=7,5.10-2x20.10-3=1,5.10-3
ma=naxM=1,5.10-3x97=1,4.10-1
La dernière question est : en déduire le pourcentage de substance active dans le détartrant étudié. Je ne trouve pas aidez moi SVP
*** image de l'énoncé scanné effacée ***
Edit Coll : les scans sont autorisés pour les graphiques, tableaux, figures... mais les énoncés doivent être recopiés 
![]() [lien]
[lien]
Salut !
!
1) Fais l'effort de recopier ton énoncé stp. Je porte déjà des lunettes et c'est très désagrable d'essayer de déchiffrer ta petite image...
2) Tu as oublié toutes les unités... Et sans ceci, il est peu aisé de t'aider
na est en mol et ma est en g
Voici mon énoncé :
Un détartrant pour cafetiere vendu dans le commerce se presente sous la forme d'une poudre blanche:l'acid sulfamique qui , en solution a les mêmes propriétés que l'acide chlorhydrique et que l'on notera HA.
On dissout 1,50g de ce détartrant dans de l'eau distillée a l'intérieur d'une fiole jaugée de 200 mL que l'on compléte ensuite au trait de jauge. On dispose alors d'une solution S de concentration en acide Ca.
On dose 20mL de S par une solution aqueuse d'hydroxyde de sodium (souse) de concentration cb=0,10mol.L-1
La courbe donnant la conductance G de la solution en fonction du volume vb de solution d'hydroxyde de sodium versé est donné ci_aprés
Ma foi tes calculs m'ont l'air correct en supposant que n soit en mol et m en g.
Tu trouves 0,14 g de quoi?
C'est la masse d'acide sulfamique et je trouve 1,4 g donc c'est ok car dans l'énoncé ils disent 1,5 g
Pouvez vous m'aidez pour calculer le pourcentage de substance active dans le détartrant étudié? svp
M'enfin je trouve que ta masse est faible. Je refais les calculs (pourtant la concentration semble bonne).
(pourtant la concentration semble bonne).
Pour la masse d'acide sulfmaique je fais m=nxM et je trouve 0,1455g J'ai arrondi a 1,4.10-1 c'est bon?
Moi j'ai fait comme si j'avais un tableau d'avancement.
J'ai donc ni(H3O+) = 1,5.10-3 mol.
Donc dans 20 mL tu as [H3O+) = 7,5.10-2 mol.L-1.
La concentration en ionx oxonium est la même dans les 20 mL que dans la solution S de 200 mL (car simple prélèvement).
On calcule la quantité de matière d'ions oxonium dans S:
n(H3O+) = [H3O+]V
n(H3O+) = 7,5.10-2*200.10-3 = 1,5.10-2 mol.
m = nM = 1,5.10-2*97 = 1,4 g dans 1,5 g de détartrant.
Calcul du pourcentage massique:
Pm = (1,4*100)/1,5 = 93 %
Le détartrant est composé à 93% d'acide sulfamique.
Posté par toinou80 toinou80
est-ce 1,4 g d'acide sulfamique présente dans la solution S?
OK merci bcp pr votre aide !
J'ai une autre qu° a vous poser qui n'a pas de rapport avc se qu'il s'est dit précédemmment :
Pourquoi est-il nécéssaire d'ajouter de l'acide sulfurique dans une solution contenant de l'eau oxygénée de concentration c=1mol.L-1 diluée 20 Fois alors que l'on va ajouté progressivement une solution de permanganate de potassium de concentration c=2,0.10-2mol.L-1 ???
Tu peux me tutoyer...
Car cette réaction d'Ox/Red nécessite un milieu acide pour avoir lieue. As-tu essayer d'écrire l'équation? Tu vas constater la présence d'ions hydronium



