Inscription / Connexion Nouveau Sujet
Données incomplètes
Bonsoir, vous pouvez m'aidez à faire cette exercice:
Compléter le tableau ci-dessous pour que les réactifs de la réaction 2 Al + 3 I2 2 AlI3 soient
introduits dans les proportions stchiométriques.
Données : M(Al) = 27,0 g.mol-1 ; M(I2) = 253,8 g.mol-1
Merci d'avance! 
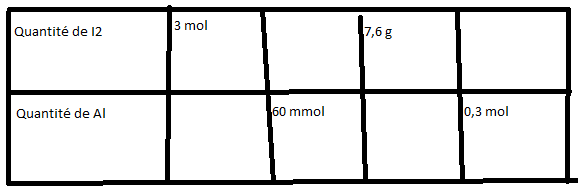
J'ai pas compris en faite j'étais pas là quand ils ont fait la leçon c'est pour ça.
Tu m'expliquer.  stp merci!
stp merci!
Pour la réaction : aA + bB ==> cC + dD
n(A)consommé/a + n(B)consommé/b = n(C)produit/c + n(D)produit/d
Donc Si ni(A)/a = ni(B)/b
on est dans les proportions stchiométriques : les réactifs sont entièrement consommés. On a ni(A) - a*xf = 0 et ni(B)-b*xf = 0. On calcule xf et on peut calculer c*xf et d*xf.( mais ça c'est pas pourquoi le tableau d'avancement? )
Mais on le complète comment le tableau en faite quelle calcul faut utiliser pour trouver le résultat ? :/
ok pour la première, tu peux mettre 0,09 mol = 90 mmol pour la seconde
le dernier c'est 0,3 mol ou 0,03 mol de Al. Si c'est 0,3 mol de Al tu as 0,45 mol de diiode sinon c'est ok.
n = m/M. D'où 7,6 g de Al c'est 7,6/27 = 0,28 mol de Al
bonjour,
je suis en 1ereS et j'ai le meme exercice a faire que ci dessus, malgré les explications je ne comprend toujours pas les calculs qu'il faut faie...
Quelqu'un pourrait m'aider svp ?
Bonjour,
Dsl de ne pas avoir répondu, je n'avais pas vu le msg.. En fin de compte nous avons corrigé les exercices en cours et j'ai compris 😊
Merci quand même d'avoir répondu,
Bonne journée



