Inscription / Connexion Nouveau Sujet
DM sur les quantités de matières...
Bonjour à tous, j'ai un devoir maison de chimie a rendre pour bientôt, je l'ai réussi pratiquement en entier mais j'aimerais avoir vos corrections, et remarques pour avoir une rédaction meilleure.
EXO1
(cf l'image jointe) (désolé mais avec un volume inférieur à 60ko, elle devient illisible)
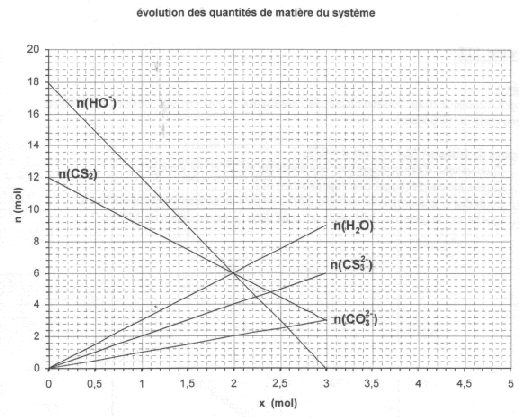
1) identifier quels sont les réactifds et les produits de la transformation.
2) indiquer les quantités de matière initiale des réactifs.
3) Déterminer la valeur de l'avancement maximal. En déduire le réactif limitant.
4) Ecrire les equations des droites du graphique. En deduire l'équation chimique de la réaction
5) A l'aide d'un tableau d'avancement, faire un bilan de matière à l'état final, retrouver les resultats graphiquement.
mes réponses:
1) au cours d'une réaction, la quantité de produits augmente alors que la quantité de réactifs diminue. Donc:
_HO[/sup]- et CS[/sub]2 sont réactifs
_H[sub]2O , CS[/sub]3^2- et CO[sub]3^2- sont des produits.
2) par lecture graphique, nHO[sup]- = 18mol et nCS[/sub]2=12mol
3) les droites s'arrêtent en x=3. 3 est dont la valeur de l'avancement maximal (une meilleure justification serait bienvenue  )
)
4) je prends 2 points M et N de chaque droite et avec la relation
 = (YM-YN)/(XM-XN) je trouve les equations réduites des droites.
= (YM-YN)/(XM-XN) je trouve les equations réduites des droites.
HO[sup][/sup]- = -6x+18
CS[sub]2 = -3x+12
H[/sub]2O = 3x
CS[sub]3^2- = 2x
CO[/sub]3^2- = x
de là je déduis l'équation
3CS2 + 6HO^- = CO3^2- + 2CS3^2- + 3H[sub]2O.
(c'était vraiment intuitif, je n'ai aucune explication...)
5)celle là je pense pouvoir la rédiger sans problèmes 
---------------------------------------------------------------------
EXO2
On a une bouteille de 1L d'acide chlorhydrique ou on peut lire
34% de HCl
densité = 1.17
Masse molaire moléculaire HCl=36.47g.mol^-1
1) Déterminer la quantité de matière en chlorure d'hydrogene HCl contenue dans la bouteille.
2) Deduire la concentration en HCl
3) Comment préparer 50mL d'HCL dix fois moins concentré que la solution précédente?
Mes réponses:
1)Sachant qu'une bouteille de 1L contitnet 34% de HCl, le volume de HCl V contenu dans la bouteille est:
VHCl= 34% * 1L = 340mL.
densité = masse volumique HCl/ Masse volumique eau=1.17
masse volumique HCl = 1.17 kg.L^-1
donc: 1L ----> 1.17kg
0.34L--> masse de Hcl
masse= 0.34*1.17 = 0.40kg.
de là, quantité de matiere = masse/ masse molaire moléculaire
n= 400g/36.47g.mol = 10.9 mol.
2) on a 10.9 mol d'HCl dans une bouteille de 1L. La concentration est donc C = 10.9mol.L^-1
3) on fait une dilution (et la j'explique le protocole) mais je vous epargne ca^^.
----------------------------------------------------------------------
EXO3
le degré alcoolique d'une boisson représente le pourcentage volumique d'éthanol dans cette boisson.
densité ethanol = 0.79.
1) quel volume d'éthanol contient une bouteille de 75cl de vin à 12°?
2) Quelle masse cela représente-t-il?
3) en deduire la quantité de matiere contenue dans cette bouteille et sa concentration.
4) quelle est la quantité d'éthanol d'un verre de ce vin de 125 mL?.
Mes réponses:
1) volume d'éthanol = 12% de 75 Cl ce qui fait 9cL
2) densité ethanol = 0.79.
donc amsse volumique éthanol / masse volumique eau = 0.79
d'ou masse volumique éthanol = 0.79kg.L^-1.
masse volumique = masse/volume
0.79 = m/0.09L
m = 0.79*0.09 = 0.071kg d'éthanol.=71.1g
3)quantité de matière ethanol = masse / masse molaire moléculaire (46g.mol^-1)
quantité de matière ethanol = 71.1/4.6 = 1.5 mol.
La concentration est donnée par
C = n/V
C = 1.5mol/0.75L = 2mol.l^-1
4) dans un verre de 125 mL on aura donc:
n = CV
n = 2mol*1.15L = 2.5mol.
Voila voila!! Merci beaucoup de passer un peu de votre temps dessus.
En espérant des corrections, et des éclaircissements sur l'exercice 1 ou je n'arrive pas à expliquer certaines choses.
Merci beaucoup
édit Océane : image placée sur le serveur de l'
apparement j'ai fait une erreur pour les indices/puissances ca passe pas...
Pour le premier exercice il s'agit de:
HO- ; CS2 ; H2O ; CS3^2-; CO3^2-
. Si vous n'avez pas le temps de tout regarder, veuillez juste m'aider pour le 3) et 4) de l'exercice 1. (j'ai trouv les réponses mais je ne saurais pas les justifier.)
Merci
Bonjour, pour la question 3) de l'exercice 1, il te suffit de dire que l'avancement est maximal lorsqu'un des réactifs disparaît complètement.
Ici, à x = 3 mol, il n'y a plus d'ions hydroxyde donc xmax = 3 mol
Fractal 
d'accord merci beaucoup. une suggestion pour la 4  ?
?
Pour l'exo I-3) tu as oublié de donné le reactif limitant qui est: HO- car la droite le representant touche l'axe des abscisses.
oui merci j'vais oublié de le noter sur le forum
Quelqu'un peut-il m'aider pour la question 4 de l'exercice 1 s'il vous plait? merci d'avance
Bonjour,
C'est très bien tout ça. Clair, bien expliqué ; avec les unités partout...
Quatrième question de l'exercice 1 : bien sûr (comme toujours...) la deuxième partie de cette question suit la première partie ! Tu viens de déterminer (correctement) les cinq coefficients directeurs des cinq droites du graphique : regarde les cinq coefficients stchiométriques... et c'est aussi la clef de la construction des tableaux d'avancement.
Troisième question de l'exercice 2 : sans expliquer le protocole tu peux, si tu le désires, faire contrôler les valeurs trouvées pour la dilution (volume de la prise de solution mère et volume de l'eau ajoutée).
Quatrième question de l'exercice 3 : étourderie (pour se prémunir, si possible, contre les étourderies : toujours calculer, approximativement, de tête avant d'aller taper sur les touches de la calculatrice). Dans un litre : 2 moles, donc dans 0,125 litre...
Bravo !

Merci bien pour vos réponses. Oui en effet ce que j'ai écrit pour la question 4 de l'exercice 3 n'a pas de sens ^^
Ce serait plutot 2.5 milimoles...
Pour l'exercice 1 question 4, je vois bien que les coefficients directeurs correspondent aux coefficients stocheométriques, mais ce que je ne saurais pas faire c'est justifier:
par exemple
HO^- = -6x+18 , ca revient a dire que dans les réactifs de l'équation chimique on aura 6HO^-, mais que représente le 18? Si vous deviez vous aussi rédiger ce devoir maison, pouvez vous me dire "texto" votre justification?
merci d'avance.
18 représente la quantité initiale de ce réactif (avant le début de la réaction, c'est-à-dire quand l'avancement x = 0)
Il y a un seul coefficient directeur égal à 1 et un seul coefficient stchiométrique égal à 1 : celui de CO32-
Cela signifie que 6 moles d'HO- disparaissent pour qu'apparaissent une mole de CO32-

oh d'accord j'ai compris. Merci beaucoup... Ayant tous les éléments, je crois que je vais pouvoir mettre mon DM au propre. ( en espérant une note correcte à la clef  )
)
Merci encore!


