Inscription / Connexion Nouveau Sujet
DM de chimie : piles - pH
Bonjours j?ai un devoir à rendre et je bloque sur cette partie toute aide serais la bienvenue merci ?
Dans certaines conditions, il est possible d?isoler un e ?tat d?oxydation interme ?diaire de l?acide `
ascorbique note ? A?? dont on ne de ?taillera pas la structure. A l?aide de donne ?es expe ?rimentales, on a pu e ?tablir se ?pare ?ment les diagrammes pour les e ?quilibres re ?dox entre A?? et les formes acido-basiques de AH2 d?une part (en lignes orange) et entre A?? et les formes acido-basiques de DAH d?autre part (en pointille ?s bleus).
On a en particulier les deux demi-e ?quations suivantes avec les potentiels standard associe ?es a` 298 K :
DAH+e? =A?? E? =?0,16V A?? +2H+ +e? =AH2 E? =+0,96V
1. Que pouvez-vous conclure quant a` la stabilite ? de l?espe`ce A?? en solution aqueuse dans toute la gamme de pH ?
2. Montrer qu?il est possible de retrouver la valeur de E? du couple DAH/AH2 de ?termine ?e expe ?rimentalement dans la Partie II a` partir des donne ?es.
3. Le diagramme repre ?sentant les espe`ces stables est reproduit sur la page suivante. Placer les espe`ces correspondantes dans leurs domaines de pre ?dominance respectifs. On pourra reproduire sche ?matiquement le diagramme sur la copie.
4. On peut lire dans un journal a` la rubrique Forme & Bien e?tre l?affirmation suivante a` propos de la vitamine C.
C?est une vitamine fragile ; utilise ?e comme antioxydant, elle va consommer l?oxyge`ne, et donc s?oxyder avant le principe actif qu?elle prote`ge ainsi.
`
A l?aide de vos connaissances, discuter cette affirmation dans les conditions physiologiques
de pH a` l?aide d?arguments chiffre ?s.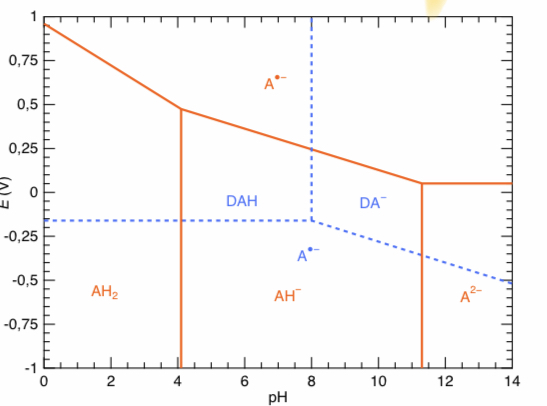
***Titre changé***
Bonjour,
Le but du forum n'est pas de faire l'exercice à ta place, il faut que tu nous précises tes pistes de réflexion :
Cet exercice a déjà reçu une aide ici :
Bonjour gbm, bonjour Mata04
@Mata04
J'ai effectivement fourni de l'aide sur ce problème très récemment (référence rappelée par gbm). Je te suggère de lire très attentivement les réponses fournies puis, si tu le juges utile, de poser des questions complémentaires ici.
Bonjour vanoise,
En fait, c'est 5 membres qui bossent sur le même DM en même temps :
* shawlee : ![]() DM de chimie : piles - pH
DM de chimie : piles - pH
* kaka123 / kevin93 : ![]() DM de chimie : piles - pH
DM de chimie : piles - pH
* Drogba / kevin93 : ![]() DM de chimie : piles - pH
DM de chimie : piles - pH
Économise-toi donc en ne faisant par les mêmes explications 3 ou 4 fois ...
Bonjour,
J'ai aussi un problème avec la question 4 de ce sujet ou l'on doit affirmer le propos suivant : "C'est une vitamine fragile ; utilisée comme antioxydant, elle va consommer l'oxygène, et donc s'oxyder avant le principe actif qu'elle protège ainsi"
Ils nous ai demandé, à l'aide de nos connaissances, de discuter de cette affirmation dans les conditions physiologiques de pH a l'aide d'arguments chiffres.
Je connais le pH physiologique, l'équation de dissociation de l'acide ascorbique dans l'eau, le potentiel standard du couple DAH/AH2.
Je ne vois pas trop comment relier les informations et affirmer la phrase ci-dessus.
Dois-je m'aider du diagramme de Pourbaix et regarder au pH physiologiques les espèces stables? Je suis un peu perdue..
Merci de votre aide.
Il faut effectivement s'intéresser au diagramme de Pourbaix pour pH voisin de 7,4.
Il est question de réaction sur le dioxygène. Pourrais-tu ajouter sur le diagramme la ligne frontière correspondant au couple O2/H2O ? Cela va sortir un peu du cadre vers le haut mais il s'agit d'une étude qualitative.
Rappel : E°O2/H2O)=1,23V à 25°C.
Bonjour,
Je viens de rajouter la ligne frontière correspondant au couple O2/H2O.
Je vois bien les espèces présentes au pH physio mais je ne comprends pas bien le raisonnement ave O2/H2O.
merci
@ psst
Principal intérêt des diagrammes de Pourbaix : visualiser au premier coup d??il les réactions possibles d'un oxydant d'un système sur un réducteur de l'autre système en superposant les deux diagrammes. Ici, on superpose le diagramme de Pourbaix de l'acide ascorbique à celui de l'eau. Si le domaine d'existence ou de prédominance d'un oxydant d'un système et le domaine d?existence ou de prédominance d'un réducteur de l'autre système sont disjoints (pas de partie commune), il faut prévoir une réaction quasi totale entre ces deux espèces. En revanche, pas de réactions si les domaines possèdent une partie commune.
C'est comme cela qu'il a été possible d'affirmer en début de problème que A°- est instable quel que soit le pH.
Ici, à pH= 7,4, le domaine de prédominance de AH- et le domaine d'existence de O2 ont-ils une partie commune ?
Bonsoir,
D'après mon diagramme, à pH 7,4, le domaine de prédominance de AH- et le domaine d'existence de O2 n'ont pas de partie commune, en revanche, O2 et DAH ont une partie commune au pH physiologique.
Donc dois-je en conclure qu'il n'y as pas de réaction entre le domaine de DAH et celui de O2. En revanche, comme le domaine de prédominance de AH- et celui de O2 sont disjoints, la réaction est quasi totale entre ces deux espèces.
Donc concernant la question initiale, si il y a une réaction quasi totale entre ces deux espèces, c'est qu'il y a bien une réaction d'oxydation?
On peut effectivement prévoir une oxydation quasi totale de AH- en DAH par O2 ; je te laisse écrire l'équation bilan.
Non. Peux-tu commencer par écrire les deux demies réactions : celle d'oxydation de AH- en DAH et celle de réduction du dioxygène en eau ?
Bonjour, j'ai réussi a comprendre votre raisonnement. J'ai essayé de placer la ligne frontière correspondant au couple 02/H2O mais je n'y arrive pas. Pourriez vous m'expliquer comment y parvenir ? merci d'avance
Pour le couple O2/H2O
L'eau étant le solvant en solution diluée, son activité vaut 1. On suppose que l'existence du dioxygène correspond à du dioxygène présent comme seul gaz en équilibre sous la pression standard (c'est un peu arbitraire mais il s'agit d'une convention). Donc
D'où l'équation de la ligne frontière :
Bonjour, es-ce correct ?
demi equation:
oxydation de AH- en DAH
H+ + DAH + 2e- = AH- + H+
réduction du dioxygène en eau
O2 + 4H+ + 4e- =H2O
2AH- + 6H+ + O2 = H20 + DAH
je retente ma chance
Ce n'est pas une question de chance, plutôt une question de méthode...
En utilisant les formules brutes, ton équation s'écrit :
On voit tout de suite que cette équation ne respecte pas la conservation de l'élément hydrogène.
Oxydation de AH- :
réduction du dioxygène :
Équation bilan :
ou si tu préfères :


 moteur de recherche
moteur de recherche page de choix du forum
page de choix du forum fiches du site
fiches du site
