Inscription / Connexion Nouveau Sujet
DM de chimie : piles - pH
Bonjour,
j'ai un devoir maison en 3 partie.
Pourriez-vous m'aider pour la dernière partie d'abord s'il vous plait ?
1.1. Déterminer le nombre d?oxydation de chacun des atomes de carbone dans les molécules AH2 et DAH. Utiliser ensuite la formule brute pour déterminer le n.o. moyen du carbone dans chaque mole ?cule. Comparer les résultats obtenus.
1.2. Donner l?expression du potentiel de Nernst associe ? au couple forme ? par les molécules DAH et AH2, en fonction des activités, puis en fonction de variables de composition et enfin en fonction du pH.
2. Donner l?expression du potentiel de Nernst associé au couple Fe(CN)63 ? /Fe(CN)64 présent dans la demi-cellule de gauche sachant que la demi-équation associée est :
Fe(CN)63?(aq) + e? = Fe(CN)64?(aq)
3.On mesure aux bornes de la pile une différence de potentiel de U=+51,7mV.
3.1. Quelle est la réaction de fonctionnement de la pile? On expliquera la de ?marche utilise ?e pour la déterminer.
3.2. Faire un schéma de la pile, en indiquant le sens de circulation des électrons, du courant, des ions dans le pont salin, ainsi que la polarité ? et le nom des électrodes.
3.3. Déduire de la mesure effectuée la valeur du potentiel standard du couple formé par les molécules DAH et AH2.
3.4. Calculer la constante d?équilibre de la réaction de fonctionnement de la pile.
***Titre complété => merci de préciser le chapitre ou le thème abordé la prochaine fois !***
Bonjour
La somme des nombres d'oxydation doit être égale à la charge de la structure soit zéro pour une molécule...
Tu peux expliquer la méthode utilisée ?
bonjour,
j'ai fais la somme des no de AH2 = 0
ce qui m'a donné 6*no(C) + 8*no(H) + 6*no(O) = 0
no(H) = -I , et no(O)= -II
donc 6*no(C) = -8 +12
no(C) = 2/3 => no(C) = +II/III
j'ai fais la même méthode pour trouver DH2
DH2 = 0
ce qui m'a donné 6*no(C) + 6*no(H) + 6*no(O) = 0
no(H) = -I , et no(O)= -II
donc 6*no(C) = -6 +12
6*no(C) = +6
no(C) = +I
par contre la suite de la question c'est déterminer à partir de la formule brute le nombre d'oxydation, je dois faire la structure de Lewis ?
Les formules développées suffisent. Il y a lieu de distinguer le cas du carbone fonctionnel du cas des autres carbones appartenant au radical alkyle.
@Drogba : tu as très bien compris comment obtenir les nombres d'oxydation à partir de la formule développée. Problème : cette formule est fausse. Elle n'est pas conforme à la règle de l'octet pour O. Comme l'as fait remarquer shawlee, il y a bien un cycle à prendre en compte. Tu trouveras la formule développée de l'acide ascorbique ici :
![]()
Pour l'acide déshydroascorbique :
![]()
Une des définition des nombres d'oxydation peut servir ici : le nombre d'oxydation d'un atome est la charge que prendrait cet atome si toutes les liaisons se coupaient en tenant compte des états de polarisation des liaisons.
Quant une liaison entre atomes identiques se coupe, chaque atome récupère l'électron qu'il a mis en commun puisque la liaison n'est pas polarisé : pas de charge apportée par la coupure. Quand une liaison entre atomes différents se coupe, cette liaison étant polarisée, l'atome le plus électronégatif garde les deux électrons, ce qui donne une charge - sur l'atome le plus électronégatif et une charge + sur l'atome le moins électronégatif.
En utilisant la numérotation des C utilisé par le lien fourni pour l'acide ascorbique, cela donne pour cet acide ascorbique :
C n°1 : +III
C n°2 : +I
C n°3 : -I
C n°4 : 0
C n°5 : 0
C n°6 : +I
Cela donne bien une moyenne de
j'ai rien dis, je trouve aussi -I pour le Cn6
pour la 2eme molécule, si on considère que le premier C est celui de droite.
on a Cn1, Cn2, Cn3 = +II
Cn4 =-I
Cn5 = +I
Cn6= +I
Mais je trouve:
C1=+3
C2=+1
C3=+1
C4=0
C5=0
C6=-1
Et j'ai la moyenne vaut 2/3....
Pour la molécule d'acide ascorbique j'ai effectivement posté trop vite. shawlee a raison. Désolé...
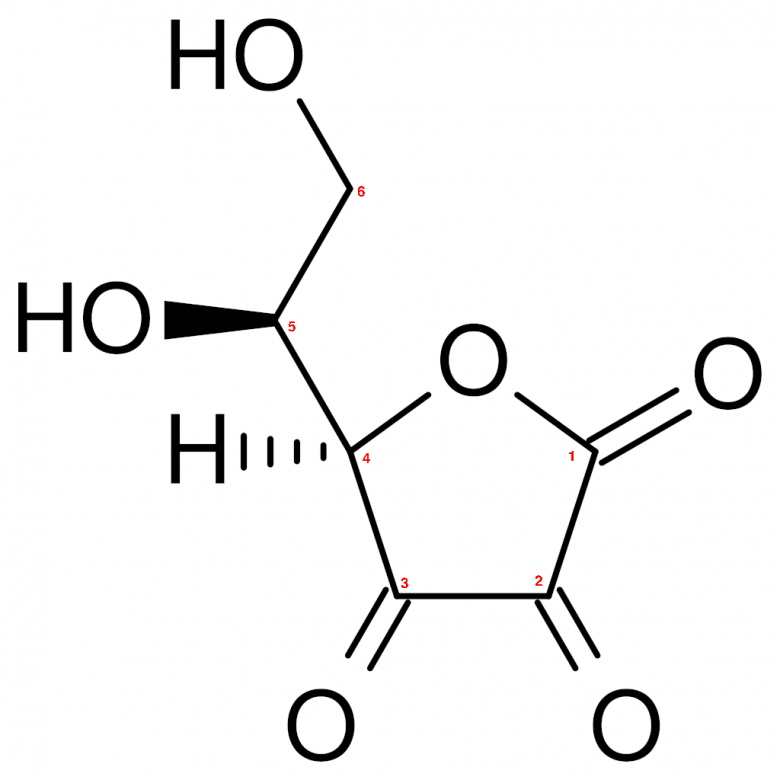
Pour DAH, en respectant la numérotation des carbones ci-dessous et en espérant ne pas me tromper cette fois-ci :
C n° 1 : +III
C n° 2 : +II
C n° 3 : +II
C n°4 et C n°5 : 0
C n° 6 : -I
moyenne : +I
Pas de soucis ! merci beaucoup.
Fe(CN)63−(aq) + e− = Fe(CN)64−(aq)
pour la suite le potentiel de Nerst de cette équation est bien
deltaE = E0(Fe(CN)6^-3/Fe(CN)6^-4 + RT/1F*ln((Fe(CN)6^-3)/(Fe(CN)6^-4)) ?
Ce qui tu as écrit, correctement, est la formule de Nernst donnant le potentiel E du couple. Je ne vois pas l'intérêt de la notation  E.
E.
d'accord merci;
je viens de voir votre réponse pour le calcule de no de la molécule 2, y'a une erreur...
Bonjour à tous,
comment vous faites pour la 3.3 merci.
@kevin93 : je ne te vois jamais proposer la moindre piste de réflexion sur les questions que tu poses. Pourrais-tu lire attentivement ceci (accepté à l'inscription) :
Merci
Tu as dû écrire les potentiels de Nernst de chacune des deux demies piles. La différence de ces deux potentiels est indiquée par l'énoncé. Elle fait intervenir la différence des potentiels standard.
Pour obtenir les valeurs numériques, des indications doivent être fournies sur les diverses concentrations, soit dans l'énoncé, soit sur le schéma que tu pourrais d'ailleurs scanner et poster ici.
Bonjour,
@Drogba : attention vous êtes actuellement 5 à bosser exactement sur le même sujet :
* shawlee : ![]() DM de chimie : piles - pH (on retrouve la valeur de différence de potentiel à 51,7 mV que pour Drogba)
DM de chimie : piles - pH (on retrouve la valeur de différence de potentiel à 51,7 mV que pour Drogba)
* kaka123 / kevin93 : ![]() DM de chimie : piles - pH
DM de chimie : piles - pH
* Mata04 : ![]() DM de chimie : piles - pH
DM de chimie : piles - pH
Bossez ensemble tant qu'à faire pour économiser vanoise !
les concentrations sont
espece Fe(CN)63 Fe(CN)64 AH2 DAH
concentration (mol L−1) 4,0 × 10−3 2,0 × 10−2 2,0 × 10−3 2,0 × 10−2
du coup j'ai fait les la Différence de potentiel entre le potentiel de Nernst
des deux solutions .
Le pH est-il fourni pour la demie pile correspondant au couple DAH/AH2 ? Il intervient dans la formule de Nernst.
Pour le couple DAH/AH2 :
Pour le couple correspondant aux ions fer complexés :
La mesure de la différence des potentiels de Nernst permet d'obtenir la mesure de la différence des potentiels standard puisque les diverses concentrations sont connues.
Pour E1 j'avais trouvé :
E0(dah)-(q/n)*0,059*PH
Où j'ai n=2 et q=2 d'après la demi equation de dah/ah2
Ce qui me donne E1=E0-1*0,059*ph
Mais je comprends pas comment vous avez trouvé E0+0,295log(dah/ah2)-0.059*ph
Ah oui je viens de comprendre.
Vous avez divisé 0,059 par le nombre d'électrons de la demi équation.
Bonjour @vanoise , j'aimerai savoir si ce que jai fait est correct ou non s'il vous plait
j'ai vu votre reponse plus haut sur cette question
question 1.2: l'equation du couple DAH, AH2: DAH + 2H3O+ + 2e- = AH2 + 2H2O
ou c'est DAH + 2H+ + 2e- = AH2 ??
expression du potentiel de Nernst:
E=E°+0.059/2 log (a(DAH)*a²(H3O+)/a(AH2)*a²(H2O))
E=E°+0.059/2 log ([DAH]*[H3O+]²/[AH2]*[H2O]²)
je sais pas comment faire pour que ce soit en fonction de PH
en fonction du ph
on a:
E°=E°-m*0,059/n *pH
avec m le coefficient devant le H+
et n le coefficient devant le e-
Pour l'étude des acides et des bases, il est préférable de noter H3O+ pour bien faire la différence entre acide et base (donneur ou accepteur de H+)
Dans les autres domaines de la chimie, en oxydo réduction par exemple, les deux notations sont acceptées.
Pour faire apparaître le pH dans la formule de Nernst, remarquer :
* log(a.b)=log(a) + log(b) si a et b : réels strictement positifs ;
* log(aH+)=-pH


 moteur de recherche
moteur de recherche page de choix du forum
page de choix du forum fiches du site
fiches du site

