Inscription / Connexion Nouveau Sujet
DM Chimie
Bonjour je suis en 1ere S j'ai un Tp a faire pour demain quelqun pourrais m'aider?
Voici l'énoncé sur ce lien. ** lien vers l'énoncé effacé **
Merci d'avance pour vis réponses.
Edit Coll : si tu veux de l'aide, merci de faire l'effort de recopier ton énoncé sur le forum 
![]() [lien]
[lien]
J'ai mis un lien non pas parceque je suis fénéant mais pour que les personnes qui souhaite m'aider puissent voir les shémas!
ETUDE D'UNE TRANSFORMATION CHIMIQUE
ETUDE D'UNE TRANSFORMATION CHIMIQUE
I- Les Quantités de matières initiales
On fait réagir une longueur L = 8,0 cm de ruban de magnésium, soit une masse m = ……….. g , avec un volume Va = 25 mL d'acide chlorhydrique de concentration Ca = 2 mol.L -1 . Il est prévu que tout le magnésium disparaisse ( facteur limitant)
a. En ions hydronium : ……………………………………………………………………………………….………………
b. En atomes de magnésium : …………………………………………………………………………….………………….
…………………………………………………………………………………………………………………………………
II- Le dispositif
Introduisez l'acide dans l'erlen + 3 gouttes de BBT.
Introduisez ensuite le magnésium roulé ou plié dans l'erlen et recueillez le gaz sans perte.
Ajustez ensuite le niveau de l'eau dans les deux récipients à peu près au même niveau.
Lisez le volume de gaz récupéré :
Vg = ………... mL
shema voir: 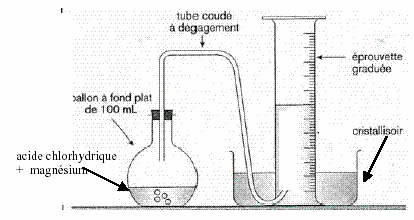
III- Identification des produits (répartir le liquide final dans trois tubes à essai)
a. Testez le gaz : ………………………………………………………………………………………………….
b. Le Cation dans l'erlen : ………………………………………………………………………………………..
…………………………………………………………………………………………………………………………
milieu final + NET + soude milieu final + soude Eau distillée + soude + NET
IV- Le tableau d'avancement Complétez ce tableau
Quel est le facteur limitant ? ………………………………………………………………………………………………………………..
IV- L'état final théorique
A l'aide du tableau d'avancement, calculez les quantités des espèces chimiques présentes dans l'erlen, autres que l'eau, à la fin de la transformation. Vous en déduirez les concentrations molaires.
V- Cas particulier du gaz (confrontation expérience et théorie)
Calculez le volume molaire des gaz Vm dans les conditions de cette expérience.
Calculez, à l'aide du tableau d'avancement, la quantité théorique de gaz (en mol) attendue n G th ,
en déduire le volume théorique attendu V g th , comparez avec le volume recueilli Vg
Données :
L'ion Mg2+ , Couleur en solution : incolore , Réactif de reconnaissance : ion hydroxyde HO-
Test de reconnaissance : précipité blanc d'hydroxyde de magnésium Mg(OH)2
Mg2+ + 2HO- Mg(OH)2 ; Remarques : insoluble dans un excès de soude
Attention : l'ion HO- réagit aussi avec l'ion hydronium de l'acide qui reste.
Le noir d'ériochrome T (NET) est violet-lie de vin en présence d'ions calcium et magnésium et bleu dans l'eau distillée.
Dihydrogène : Peut facilement être enflammé dans l'air avec un "aboiement" caractéristique.
Edit Coll : image placée sur le serveur de l'  Merci d'en faire autant la prochaine fois !
Merci d'en faire autant la prochaine fois ! 
![]() [lien]
[lien]


