Inscription / Connexion Nouveau Sujet
Dilution
On dispose au laboratoire d'une solution S(0) d'acide sulfurique H2SO4 de concentration molaire C(0) = 3,5 mol/L
On désire préparer V1= 200mL de solution d'acide sulfurique, notée S(1) de concentration molaire C(1) = 8,75. 10-² mol/L.
a) Etablir la liste du matériel necessaire à la préparation de S(1)
. Une pipette jaugée( mais pour savoir de combien de ml, il faut que je trouve le volume de la solution mère à prélever ..
. de l'eau distillée
. FIole jauge de 200 ml ( Volume de la solution fille) qui permettra de diluer le volume de la solution mère prélevée.
b)Décrire la préparation de S1:[
Il faut savoir le volume de la solution mère V1 à prélever.
Cm.Vm = Cf.VF
Ainsi, Vm = CF.VF / Cm
Vm = 8,75.10^-2*200 / 3,5 = 4,85 ml
Comment arrondir ? J'arrondie à un chiffre significatif ou deux ?
Je prélève ce volume de la solution mère à l'aide d'une pipette jaugée ( + poire ) pipeter), j'introduis la solution prélevée dans une fiole jaugée de 200ml, je remplis la fiole jaugée avec de l'eau distillée en ajustannt bien le ménisque au trait de jauge sans oublier de l'homogénéiser !
[b]2) On veut diluer 40 fois la solution S1: la solution obtenue est notée S2 son volume est de 250 mLa/ Déterminer la concentration C2 de la solution S2:
SI on dilue 40 fois, cela signifie que l'on ajoute de l'eau à une solution jusqu'à ce que le volume final soit 40 fois plus grand que le volume du départ. Et la concentration est divisé par 40 . C'est ça ?
3,5/40 = 0,0875mol/L
ou alors, je peux ré-utiliser cette formule, Cm.Vm = CF.Vf
donc, CF = Vf/ Cm.Vm
Cf = 200/ 3,5.4,8
cf = 11,9 mol/L Et je ne trouve pas pareil du coup !
0,0875 mol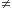 11,9 mol ..
11,9 mol ..
b/ Quel volume de solution S1 doit-on prelever pour préparer S2? Quelle est la verrerie utilisée pour ce prélevement?
j'ai déjà répondu cette question..
Il faudra utiliser une pipette graduée !
je vous remercie !!
Lunie
Bonsoir,
1) deux chiffres significatifs (imposé par 3,5)
2) C'est la solution S1 qu'on dilue 40 fois, pas S0
8,75.10^-2 / 40 = concentration de C2 ?
les chiffres significatifs sont les chiffres après la virgule ?
Sinon, le reste est bon ou pas ?
Je ne comprends pas
On veut diluer 40 fois la solution S1: la solution obtenue est notée S2 son volume est de 250 mLa/ Déterminer la concentration C2 de la solution S2:
Donc, la concentration S1 de la solution S1 est divisée par 40 ( la concentration est 40 fois plus petite)
(8,75.10^-2)/40 = 2,18.10^-3 mol/L
OU
C1.V1=C2.V2
C2 = V2/(C1V1)
C2 = 250/(8.75.10^-2*200) =14,2 mol/L
Je trouve tjs pas pareil.. 
 S'il vous plait ..
S'il vous plait ..
Ah .. je peux pas faire ça ?
2,18.10^-3 mol/L est la bonne concentration après avoir dilué 40 fois la solution fille ?
"(8,75.10^-2)/40 = 2,18.10^-3 mol/L" ==> OK
On veut une solution S2de volume 250 mL et de concentration C2 = 2,18.10^-3 mol/L.
Le plus simple est d'appliquer C1V1 = C2V2 effectivement.
ok merci!
En fait, pour trouver la concentration de S2 après dilution
on ne peut trouver le résultat que en faisant : (8,75.10^-2)/40 ?
on ne peux pas trouver 2,18.10^-3 mol/l en appliquant la formule c.v =c'v' ?
ok pour la dernier question !

 :o
:o
