Inscription / Connexion Nouveau Sujet
Dilatation de l'air et calcul d'une masse
Bonjour, 
J'ai une nouvelle fois besoin de votre aide 
Je suis entrain de faire mon TPE mais je rencontre un problème pour calculer une masse suite a une dilatation
La situation :
On considère une montgolfière encore posée au sol.
On cherche la température nécessaire au décollage.
Son enveloppe de 2 200 m3 est entièrement rempli d'air chaud à 92°C.
La masse d'air dans l'enveloppe est de 2 137 kg (notée )
Le poids totale de la montgolfière (passagers + nacelle + air) est de 26 359 N (noté P_total)
La température ambiante étant de 16°C, la masse volumique de l'air qui l'entoure est égale à :
avec :
R la constante des gaz parfaits (3,314 462)
M la masse molaire de l'air (0,029 kg/m3)
P la pression en pascal (101 325 Pa)
T la température en Kelvin
Ce qui me donne
Afin que la montgolfière décolle, il faut que la poussée d'Archimède soit supérieure au poids. On sait que le volume doit être de 2213 m3 pour que P_archimède = Poids. (démonstration ci-dessous)
d'où
Je cherche à déterminer à quelle température doit être l'air porté l'air dans l'enveloppe pour atteindre ce volume. De ce fait, j'utilise la loi des gaz parfaits :
Or la j'ai un hic, je n'arrive pas à calculer la masse d'air dans l'enveloppe après dilatation.
Je sais que
Sauf que je n'arrive pas à déterminer des 13 m3 qui sont sortis de l'enveloppe.
Pourriez-vous m'aider ou me donner une piste svp ?
Bonne après midi et merci d'avance
Tu ferais mieux de donner l'énoncé sans en modifier un seul mot.
Tu mélanges l'énoncé avec des morceaux de raisonnements personnels ... et cela devient incohérent.

Bonsoir,
Ah d'accord !!
En réalité j'ai moi-même imaginé ce problème, d'où cette sensation d'incohérence à mon avis...
J'ai rédigé un énoncé en essayant d'être le plus clair possible (je me suis beaucoup inspiré d'un sujet similaire présent sur le site) :
On souhaite faire décoller une montgolfière, dont l'enveloppe peut contenir au maximum 2 200m3. La température ambiante est de 16°C. La charge des équipements (nacelle, brûleur, etc...) est de 340 kg.
L' objectif de l'exercice est de déterminer à quelle température l'air contenu au sein de l'enveloppe doit-il être porté afin que celle-ci décolle.
La 1ere étape consiste à envoyer (grâce à de puissants ventilateurs) de l'air à température ambiante dans l'enveloppe. On envoie une quantité d'air Va environ égale à quatre cinquième du volume maximum de l'enveloppe.
1) Calculer Va.
2) Calculer la masse d'air à 16°C envoyé dans l'enveloppe.
3) Calculez le poids de l'air puis le poids total de la montgolfière.
4) a. Calculer la valeur V1 du volume que devrait avoir l'enveloppe pour que la poussée d'archimède ait la valeur du poids total de la montgolfière.
b. Que devrait alors être la masse volumique de l'air ?
c. Quel température faut-il chauffer l'air pour atteindre cette valeur ?
5) Deux passagers montent dans la nacelle. La somme de leur masse est de 210 kg. (oui je me suis fait plaisir  ).
).
a. Calculer le nouveau poids de la montgolfière.
b. Calculer la valeur V2 du volume que devrait avoir l'enveloppe pour que la poussée d'archimède soit de nouveau égal au poids.
c. Que pouvez-vous dire sur ce volume ?
6) Pour atteindre ce volume, le pilote continu de chauffer l'air dans l'enveloppe. L'air se dilate jusqu'à remplir totalement les 2200m3 de l'enveloppe. (voir schéma)
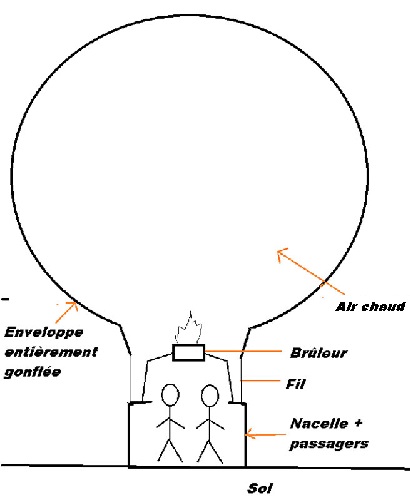
a. Que pouvez-vous désormais dire sur la poussée d'Archimède ?
b. Comment évoluera la quantité de matière au sein de l'enveloppe si l'on continue de chauffer l'air ?
7) On continue de chauffer afin que la poussée d'Archimède soit égale au poids.
a. Calculer la masse d'air perdue .
b. En déduire la nouvelle masse volumique au sein du ballon.
8) Déterminer la température V3 nécessaire au décollage. Concluez
J'espère que c'est plus clair comme ça 
Je bloque à la question 7.
Je vous poste ce que j'ai fait dans un autre message.
1 ) Va = 4/5 * 2 200 = 1760m3
2)
Il faut exprimer la masse volumique en fonction de la température. On utilise l'équation des gaz parfaits :
avec
P la pression en Pascal (ici la pression atmosphérique, soit 101 325 Pa)
V le volume en m3
n la quantité de matière en moles
R la constante des gaz parfaits (8. 314 462)
T la température en Kelvin
d'où :
et M la masse molaire de l'air (env 0.0288 kg/mol)
donc :
3)
4) a. En utilisant la formule de la poussée d'archimède on obtient :
b.
c. En utilisant la loi des gaz parfaits, on obtient l'expression :
ce qui donne :
5) (je vais un peu plus vite dans les calculs vu que c'est simple ici et c'est le même principe)
a.
b.
c. V2 > V_enveloppe
6)
a. La poussée d'archimède devient constante car le volume de l'enveloppe est à son maximum
b. La quantité de matière au sein de l'enveloppe va diminuer si l'on chauffe davantage. En effet, avec la dilatation de l'air, la pression augmente dans le ballon donc les molécules d'air s'échappent par l'ouverture de l'enveloppe.
Je bloque à la question 7. Je n'arrive pas à déterminer la masse d'air que je perds pour atteindre les 2 213 m3. Est-ce parce que je manque de données? Si ce n'est pas le cas pourriez vous m'aider ?
Ce n'est pas comme cela qu'il faut approcher le problème.
On envoie de l'air froid dans l'enveloppe et puis on le chauffe.
Une partie de l'air mis au départ dans l'enveloppe va s'échapper au cours du chauffage (mais on s'en fout).
Le résultat final est un volume V = 2200 m³ d'air chaud qui reste dans le ballon ... et peu importe la quantité d'air froid du départ qui aura été éjecté, ceci n'influence pas le décollage de la mongolfière.
Le problème initial se résume à :
Un ballon contient 2200 m³ d'air chaud (température T) (et on se fout de savoir comment on y arrive et en particulier de l'air qui en aura été éjecté au cours du chauffage, on peut la calculer si on veut ... mais cela n'influence en rien le décollage).
L'air ambiant est à 16°C
La masse de l'enveloppe vide (sans air) + la masse de la nacelle + la masse des équipements est de 340 kg (c'est peu mais soit)
A quelle température min doit-on chauffer l'air du ballon pour qu'il décolle ?
-----------------
rho(air) = P*M/(R*T)
Poids de l'air intérieur à la mongolfière (à ne pas confondre avec Attila ... qui lui était un fier Mongol), à la température T (en K)
P1 = V * g * Rho(air) = V * g * P*M/(R*T)
Poids de l'air extérieur à la mongolfière à 16°C
P2 = V * g * P*M/(R*(273+16)) (c'est aussi la Poussée d'Archimède de l'air sur le ballon)
P2 - P1 = V*g*P*M/R * (1/289 - 1/T)
Et il y a décollage si P2 - P1 > (Poids de l'enveloppe + poids nacelle + poids équipement)
Si (Poids de l'enveloppe + poids nacelle + poids équipement) = 340 * g, alors :
décollage si : V*g*P*M/R * (1/289 - 1/T) > 340 * g
V*P*M/R * (1/289 - 1/T) > 340
(1/289 - 1/T) > 340 * R/(V * P * M)
1/T < 1/289 - 340.R/(V * P * M)
T < 1/[1/289 - 340.R/(V * P * M)]
Si on a dans le SI :
R = 8,314
V = 2200
P = 101300 Pa
M = 0,029
T > 330,8 K
T > 57,8 °C
Sauf distraction. 




