Inscription / Connexion Nouveau Sujet
Description quantitative de l’évolution d’un système chimique
Bonjour à tous, j'ai un exercice que je n'arrive pas à faire, pouvez-vous m'aider ? 
Voici le fichier: (l'image ci-dessous)
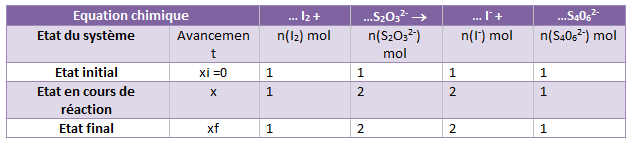
1)Compléter le tableau d’évolution du système ou tableau d’avancement lignes 1 et 2 avec les valeurs du TP.
2)Déterminez la composition du système à l’état final.
Merci d'avance! 
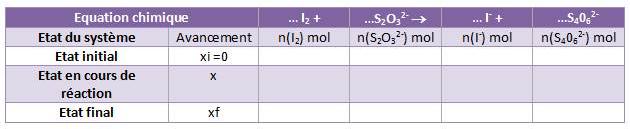
** énoncé effacé ; image laissée **
Edit Coll : si tu veux de l'aide, merci de faire l'effort de recopier ton énoncé sur le forum 
![]()
énoncé: On étudie la transformation chimique réalisée au cours des travaux-pratiques - Partie B, soit on mélange 10 mL d'une solution de diiode à 1,0.10-2 mol/L à 20 mL d'une solution de thiosulfate de sodium à 1,0.10-2 mol/L.
On utilise un tableau pour décrire le système ci dessus:
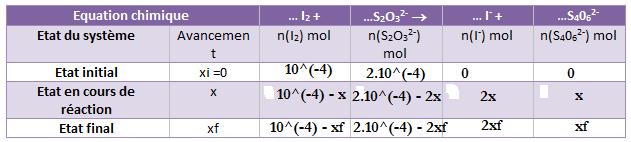
n I2= 1,0*10^-4 mol= 10^-4 mol
n S2O3O 2- = 2,0 * 10^-4
On remarque que l'on a 2 fois plus de S2O3 2- que de I2!
c uste ?
pourquoi as-tu mis 1 partout à l'état initial ?
les quantités de matière initiale, tu viens de les calculer. Et il n'y a pas d'ions iodure et tétrathionate à l'état initial
Ok, merci pour le tableau.
A la question quand ils disent Déterminez la composition du système à l'état final, c'est-à-dire ?
10-4 - xf = 0 => xf = 10-4 mol si le diiode est le réactif limitant
si le thiosulfate est limitant 2.10-4 - 2xf = 0 => 2xf = 2.10-4 => xf = 10-4 mol
donc tu as introduit les réactifs dans les proportions stoechiométriques et xf = 10-4 mol
Bonsoir, j'ai un exercice mais je n'arrive pas à répondre à ces question.
Les proportions dans lesquelles les réactifs doivent être introduits pour qu'ils soient tous entièrement consommés lors d'une transformation sont dites stœchiométriques.
On place un volume V1 = 10 mL de solution de diiode à 1,0.10-2 mol/L dans un bécher. On remplit une burette graduée de 25 mL de la solution de thiosulfate de sodium à 1,0.10-2 mol/L. On ajoute progressivement la solution de thiosulfate de sodium jusqu'à ce que la solution dans le bécher soit jaune pâle. On ajoute 2 gouttes d'empois d'amidon, puis on verse goutte à goutte la solution de thiosulfate de sodium jusqu'à disparition du diiode. C'est l'état final, il ne reste plus de réactifs dans le bécher. On relève le volume V2 de solution de thiosulfate de sodium ajouté.
7- Vérifier que ni(I2)/a = ni(S2O32−)/b
8- Comparer les quantités ni(I2)/a et ni(S2O32−)/b dans le cas des mélanges 1, 2 et 3 de la partie A, en rappelant quel est le réactif limitant.
9- A quelle condition le réactif B d'une réaction modélisée par l'équation aA + bB --> cC + dD est-il limitant ?
10- Lorsque les proportions des réactifs sont stœchiométriques, quelle relation respectent les quantités initiales des réactifs A et B ?
Merci d'avance! 
*** message déplacé ***
aI2 + bS2O3 2- --> cI- + dS4O6 2-
Réactif Produit
I- et S4O6 2- sont incolores.
a=1
b=2
c=2
d=1
1I2 + 2S2O3 2- --> 2I- + 1S4O6 2-
c'est ça ?
*** message déplacé ***
n'oublie pas l'unité...
Tu divises n(I2) par a et n(thiosulfate) par b
Compare ce que tu obtiens
*** message déplacé ***
ben je n'ai pas ces parties là. Mais tu dois faire le même raisonnement avec les quantités de matière que tu trouves
*** message déplacé ***
Pour la 9 tu dois t'appuyer sur la 8, c'est une interprétation directe
10) ni(I2) = ni(S2O32−)/2
*** message déplacé ***
ben je n'ai pas ces parties là. Mais tu dois faire le même raisonnement avec les quantités de matière que tu trouves
*** message déplacé ***