Inscription / Connexion Nouveau Sujet
Des édifices ordonnés : Les cristaux
Bonjour à tous, j'ai besoin de votre aide concernant un exercice d'enseignant scientifique. C'est un exercice qui rendre dans un devoir niveau première. Je ne suis pas scientifique dans l'âme donc c'est un exercice dans lequel je ne comprend pas grand chose. Merci d'avance pour votre aide. Voilà l'exercice :
L'or
Données : L'or cristallise dans une structure c.f.c.
La masse d'un atome d'or est m = 3,27×10−22 g
1. Démontrer que la masse volumique de l'or est p = 1,9.10^4 kg/m3. Calculer sa densité d.
2. Démontrer que le rayon atomique de l'or est r = 1,4.1010m
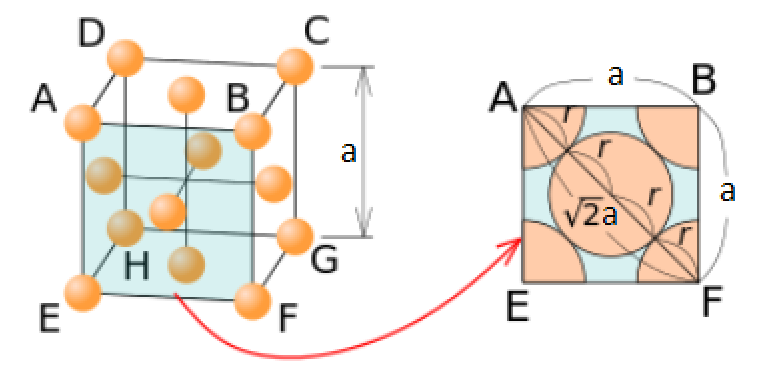
3. Rappeler la valeur de la compacité d'une maille c.f.c. et utiliser sa définition pour démontrer que le paramètre a de la maille est 400 pm. Toute autre démonstration n'utilisant pas la définition et la valeur de la compacité est acceptée.
4.Les atomes d'or sont disposés en couches ABCABC.
Calculez la distance entre deux plans consécutifs d'atomes d'or au contact.
(photo dans les commentaires)
Où j'en suis dans mon devoir :
1. La masse volumique d'un solide se calcule par la formule suivante.
p = Masse des entités dans la maille / Volume de la masse
donc : 14 / 52,5 = 0,267
Je connais la formule du calcule de la masse volumique mais je n'arrive pas à l'appliquer.
2. La formule c'est r = n2 / Z . ao mais encore une fois je ne comprends pas comment utiliser cette formule.
3. La valeur d'une maille c'est le rapport entre la masse des entités dans la maille et son volume. Et la compacité c'st le rapport entre le volume occupé par les entités composant la maille et son volume propre.
4.
Bonjour,
1. La masse volumique d'un solide se calcule par la formule suivante.
p = Masse des entités dans la maille / Volume de la masse
donc : 14 / 52,5 = 0,267
Peut être pourrais tu expliquer d'où tu sors ton 14 et ton 52,5.
0,267 sans unité n'a strictement aucun sens.
Bonjour , je pensais que la masse des entités dans la maille correspondait aux nombres de points dans le schéma, soit 14. J'ai oublié la phrase suivante : " Un lingot d'or de masse 1,00 kg occupe un volume de 52,5 mL " qui est dans l'énoncer. C'est donc de cette phrase que je sors le 52,5. Je ne sais pas dans quel unité exprimer le résultat de cette formule.
Par définition la masse volumique d'un corps est égale au rapport entre sa masse et son volume.
Ici, la masse est de 1kg et le volume de 52,5mL (qu'il faudra convertir en m³)
Il ne reste plus qu'à faire le calcul pour retrouver la valeur indiquée par l'énoncé (en kg/m³)
Donc si j'ai bien compris ça donne :
p = M / V
M s'exprime en kg et V s'exprime en m3
m3 = mL / 1 000 000
52,5 mL / 1 000 000 = 0.0000525 m3
Donc ici
p = 1kg / 0.0000525 m3
p = 19 047.619 kg / m3
Merci de votre réponse, j'espère avoir bien compris.
Bonne soirée
Ton calcul est exact.
Le résultat rendu avec 8 (!) chiffres significatifs est un peu ridicule.
Compte tenu de la précision des données de l'énoncé (3chiffres significatifs) on rendra plutôt :
 = 1,90.104 kg/m³ ou bien 19,0g/cm³
= 1,90.104 kg/m³ ou bien 19,0g/cm³
Salut,
J'ai le même devoir que SweeneyTodD17, et moi je bloque sur les questions 3 et 4
Pour la question 3 j'arrive à ça
Rappeler la valeur de compacité d'une maille CFC : (0,74)
et utiliser sa définition pour démontrer que le paramètre a de la maille est de 400pm :
a = 4R/√2 => a = (4*〖1,4.10〗^(-10))/√2 = 0,000000000396.
Je ne sais pas si c'est la bonne formule que j'utilise, et donc si 400pm est un arrondi. Mais si c'est bien ça j'ai un soucis dans les unités car je n'ai pas trouvé l'unité utilisée pour pm.
Quelqu'un a t'il des infos à ce sujet ?
Là je réfléchi et cherche des infos pour résoudre la question 4, mais j'ai l'impression de tourner en rond. Je vois bien qu'il faut que je travaille avec la distance interréticulaire, mais je bloque là. Si qqun a des infos pour que je puisse au moins démarrer l'exercice.
Merci d'avance 
Bonjour odbugt1,
Merci pour votre première piste de réponse pour la question 4 je suppose.
Le nombre d'atomes dans la maille CFC est 4 (8*1/8 + 6*1/2).
Mon problème c'est que je cherche dans mes cours comment calculer la distance entre deux plans, mais je ne trouve rien.
Y a t'il une formule pour cela ?
Merci
Ma réponse concernait les questions 2 et 3.
J'ai choisi de ne pas me servir de la compacité.
Masse volumique de l'or :  = 4m / a³ Géométrie de la maille :
= 4m / a³ Géométrie de la maille :
On a 2 relations et deux inconnues.
On en retire :
AN : r = 1,4.10-10 m = 140 pm
AN : a = 4,1.10-10 m = 410 pm
En ce qui concerne la question 4, il te faudra attendre un avis plus autorisé que le mien.
Je ne comprends pas la question et j'ignore ce que sont les couches ABCABC et les " plans consécutifs d'atomes d'or au contact. "
Coucou désolé de mettre du temps à répondre !
Merci de ton aide odbugt1 !
Je cherche aussi une solution pour la question 4 je tiens au courant si j'ai des infos Jijiv 
Bonjour
Je veux bien prendre le relais pour la question 4. D'abord quelques généralités sur les plans de compacités maximales...
Pour réaliser une structure compacte il faut d'abord imaginer de placer dans un plan des atomes de façon que le nombre d'atomes par unité de surface soit maximum. Cela s'obtient en imaginant que chaque atome est en contact avec 6 autres, les centres de ces 6 atomes occupant les 6 sommets d'un hexagone dont le centre de l'atome entouré est le centre. (les illustrations sur le net de cela sont abondantes : ici par exemple : ![]() . Appelons "A" cette couche.
. Appelons "A" cette couche.
Il faut ensuite placer au dessus de cette couche A, une seconde couche (notée B) identique à la première mais décalé de sorte qu'un atome de B occupe partiellement un creux de la couche A. La moitié des creux de la couche A sont ainsi partiellement occupés. (L'idéal est de disposer d'un seau de balles de tennis et de faire la manipulation...)
Pour la troisième couche, deux choix sont possibles :
1° : placer la troisième couche à la verticale de la couche A : on obtient alors un réseau noté ABAB qui correspond à une maille usuelle hexagonale compacte.
2° : placer la troisième couche à la verticale des creux de la couche A non occupés par la couche B. On obtient alors un réseau noté ABCABC qui correspond à une maille cfc.
Ces plans de compacité ne sont pas évidents à détecter dans la maille cfc mais la figure en couleur du message du 18-09-19 à 11:41 aide bien. Les atomes dessinés en bleu appartiennent au plan de compacité B : on y trouve 3 atomes d'une diagonale de face, deux atomes au milieux de deux autres faces et un atome à un sommet. 6 atomes du plan de compacité C sont représentés en vert. Dans la maille, un seul atome (en rouge) appartient au plan de compacité A.
Facile je pense maintenant de déterminer la distance entre les plans B et C...
Et bien Vanoise un grand merci pour tout les détails de ta réponse, mais je ne vois toujours absolument pas comment trouver une distance entre B et C. Je suis pas très scientifique je l'avoue. La réponse est-elle une distance au sens strict, avec une mesure ou une différence du nombre d'atomes ou autre ?
Commence par étudier le document référencé ici : ![]()
en particulier les pages 17 et 18. Il y est question de la structure h.c. mais, comme expliqué précédemment, les plans de compacités ont la même distance entre eux que dans la structure c.f.c mais, dans la représentation du document, ils ont l'avantage d'être horizontaux donc faciles à visualiser. La distance entre deux plans de compacité est (c/2). La figure centrale de la page 18 est valide à la fois pour la structure h.c. et pour la structure c.f.c. et permet la détermination de c en fonction de R le rayon atomique. Les atomes A,B,C appartiennent à un même plan de compacité. L'atome D appartient au plan de compacité immédiatement en-dessous.
Je te laisse réfléchir...
Bonjour Odbugt1,
Concernant votre réponse à la question 2,
j'ai beau remplacer les termes de ces formules par les valeurs connues et avoir refait maintes fois les calculs , je ne trouve pas les résultats escomptés.
Si vous aviez un développement du calcul je vous en saurai gré.
C'est pour moi le point de blocage du problème.
En vous remerciant.
Suite aux informations de Vanoise j'ai repris tout le calcul de la page 18 du document annexé avec pour la maille CFC : c = a = 4R/√2
J'arrive à un résultat final de
c = 2√2/3a => c = 2*(4R/√2)*√2/3 => c = (8R/√2)*(√2/3)
Mais comme Vanoise dit aussi que la distance entre deux plans de compacité est (c/2) je peux aussi en déduire que c/2 = a/2 = (4R/√2)/2
Je ne sais donc pas laquelle de ces deux pistes est la bonne et m'embrouille dans les multiplications/division de fraction en racine !!!
Je t'ai fourni ce document qui fait le calcul dans le cas du réseau h.c. puisque la distance entre les plans de compacité est la même que dans le cas du réseau c.f.c. mais il y a effectivement un risque "d'embrouille" car le paramètre "a" n'a pas la même expression en fonction de R dans les deux mailles. Ce document a le mérite de fournir des schémas extrêmement clairs...
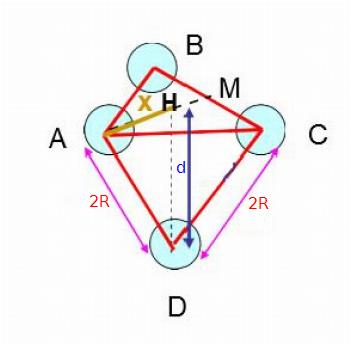
Concentre toi sur la figure centrale de la page 18 car elle est valide pour les deux types de réseaux mais la distance entre deux centres d'atomes en contact est (2R), ce qui n'est pas égal au paramètre a que tu as utilisé dans les autres questions. La distance d entre deux plans de compacité voisins est donc :
Ah Ok !!! Je comprends plus rien 
Si la distance entre 2 atomes de contact est 2R. Quelle différence avec les 2R = "a" du schéma central de la figure page 18 qui comme j'avais compris était aussi la distance entre 2 atomes en structure h.c ?
Je crois que je suis surtout embrouillée entre les "a" arrête, les "a" distance et les "A" plans.
J'étais loin d'imaginer que le fait de te fournir un document traitant à la fois des réseaux h.c. et des réseaux c.f.c. te perturberait à ce point !
Dans le cas du réseau c.f.c. qui t'intéresse, les arêtes du cube de la mailles usuelle n'appartiennent pas à des plans de compacité, les atomes ne sont pas au contact ; cela conduit à : a>2R. La situation est différentes pour une maille h.c.
S'il le faut, oublie le document que je t'ai indiqué et réalise l'expérience suivante, pour peu que tu disposes chez toi de quatre boules identiques (billes, balles de tennis ou de ping-pong...). Tu en places 3 sur une table de la façon la plus compacte possible. Comme déjà expliqué : elles doivent être en contact de sorte que les trois centres occupent les trois sommets d'un triangle équilatéral dont les côtés sont de longueurs (2R). Les trois centres, notés A,B,C sur le schéma appartiennent à un même plan de compacité. Place maintenant la quatrième boule au dessus du plan précédent de la façon la plus compacte possible : cette boule dont le centre est noté "D" sur le schéma occupe partiellement le "creux" laissé entre les trois boules précédentes, elle est en contact avec les trois autres boules ; elle appartient au plan de compacité situé juste au dessus (juste en dessous sur la figure) du plan de compacité contenant A, B et C.
La distance d entre deux plans de compacité est donc la hauteur de la pyramide dont les quatre centres occupent les quatre sommets.
Le calcul de d est développé sur le document...
Et bien dis donc Vanoise, un grand merci pour toutes tes explications et schémas qui m'ont aidé à comprendre ce problème. 
Bonjour j'ai le même problème que vous avez vous messenger ou snap pour que vous puissiez m'expliquer ?
Bonjour Vanoise!
Le document dont tu fais référence dans ta réponse du 25/09/2019 a certainement évolué depuis car ça date! Pourrais-tu me communiquer la nouvelle adresse ?
Merci par avance,
Cordialement,
Mikel !
Bonjour mikel83
Effectivement, le lien fourni n'est plus d'actualité. Voici un autre document qui illustre bien les positions relatives des plans de compacités.
Structure h.c. :
- en rouge : un plan(ici B) où on voit bien l'atome central entouré de 6 autres atomes occupant les 6 sommet d'un hexagone régulier.
- en bleu et en dessous : trois des atomes de la couche inférieure (type A) qui occupent partiellement 3 des 6 creux de la couche B.
en bleu et au dessus : trois atomes d'une couche A situés à la verticales des atomes de la couche A du dessous.
Structure cfc :
- en jaune : plan de compacité avec 7 atomes représentés
Defférences avec la structure h.c. : la couche de compacité supérieure (C) en bleu n'occupent pas les mêmes creux que les atomes de la couche de compacité inférieure (A). Les atomes de la couche supérieure ne sont pas à la verticale des atomes de la couche inférieure.
Pour les calculs, le schéma de mon message du 26-09-19 à 15:12 me semble clair et il a l'avantage d'être applicable à la fois à la structure h.c. et à la structure c.f.c. .
![]()