Inscription / Connexion Nouveau Sujet
Déductions de formules brute de composés à partir d'informations
Bonjour ,
Merci d'avance. 
En vu de déterminer la formule sémi développée d'un hydrocarbure A , on obtient les informations suivantes à partir d'une fiche sur le composé.
- L'hydrocarbure A contient 85,71 % en masse de carbone.
- À l'obscurité , A réagit mole à mole avec le dibrome. Le composé obtenu renferme 74 % en masse de boulot.
- L'hydratation de A conduit préférenciellement à l'alcool B. L'hydratation de ses isomères conduit préférenciellement au même alcool C , isomère de B.
1-) À partir de la 1ère information :
1-1) Écrire la formule générale de A.
1-2) Trouver la relation le nombre d'atomes de carbone et le nombre d'atomes d'hydrogène présents dans la formule de A ;
1-3) Préciser la famille de A.
2-) À partir de la 2ème information :
2-1) Déterminer la formule brute de A.
2-2) Écrire les formules sémi développées possibles pour A.
3-) Avec la 3ème information :
3-1) Déduire les formules sémi développées des composés A , B et C ;
3-2) Donner le nom du composé A.
Réponses
1-1) J'ai effectué une mini étude sur deux différentes familles hydrocarbures (classiques)...
* CH4 : le méthane (alcane).
On sait que
La masse molaire du carbone MC=12 g/mol.
La masse molaire MCH4 du méthane est égal à 12×1+4×1=16 g/mol.
D'où
Donc 16 × %C= 1200
%C =1200/16
%C= 75
* CH2 : le méthène (alcène).
On sait que
La masse molaire du carbone MC=12 g/mol.
La masse molaire MCH2 du méthane est égal à 12×1+2×1=14 g/mol.
D'où
Donc 14 × %C= 1200
%C =1200/14
%C= 85,71.
J'en déduis que le composé A est un alcène d'où sa formule générale est CnH2n.
1-2) La formule générale de A étant CnH2n ;
Le nombre d'atomes de carbone n égal au double d'atomes d'hydrogène.
nC=2nH.
1-3) A est de la famille des alcènes.
2-) Je ne vois pas comment procéder
Bonjour,
Commençons par l'énoncé :
On y trouve :
"Le composé obtenu renferme 74 % en masse de boulot."
Je ne sais pas ce qu'est " le boulot "
Tu as montré que l'hydrocarbure n'était pas du méthane.
C'est exact, mais c'est inutile.
Tu as ensuite inventé une molécule (le méthène de formule CH2) qui n'existe pas et tu as montré que le pourcentage de Carbone dans cette molécule fictive est bien de 85,71%
Puis de ce résultat "tu en déduis que" A est un alcène.
Ta "déduction" n'est pas justifiée.
Je t'ai déjà montré récemment comment faire :
Je recommence :
Question 1.1 :
Le composé A est un hydrocarbure.
Sa formule est de la forme CxHy
Question 1.2 :
Une mole de A a une masse (en g) égale à 12x + y
La participation en masse du carbone dans cette masse est de 12x
Le taux en masse de carbone est donc de 12x / (12x + y)
Or l'énoncé donne ce taux
Un calcul très simple, que je te laisse faire, va te permettre de trouver que y=2x
Tu avais trouvé ce résultat, mais à partir d'une démarche incorrecte et non justifiée.
Le taux en masse de carbone étant donc de
On a : de
Oui
D'où
Non
y = 2x
Question 1.3
Puisque y=2x la formule brute CxHy de l'hydrocarbure A peut s'écrire CxH2x ce qui est soit la formule d'un alcène, soit celle d'un cycloalcane.
La suite de l'exercice montre qu'il s'agit d'un alcène.
Question 2.1 :
Il faut tout d'abord trouver la formule brute du composé obtenu par la réaction décrite dans l'énoncé.
Ensuite, par un raisonnement semblable à celui déjà utilisé (question 1.2) on trouve la formule brute de A
CxH2x ce qui est soit la formule d'un alcène, soit celle d'un cycloalcane.
La suite de l'exercice montre qu'il s'agit d'un alcène.
Je ne comprends pas très bien pourquoi ..
2-1)
- À l'obscurité , A réagit mole à mole avec le dibrome. Le composé obtenu renferme 74 % en masse de brome.
D'où :
CnH2n +Br2 ----> CnHBr +HBr
Comme çà ?
Non
A l'abri de la lumière, la réaction n'est pas une réaction de substitution, mais une réaction d'addition sur la double liaison.
Revoir ton cours, si nécessaire.
Au sujet de ta question du 29-09-20 à 20:58 concernant les cycloalcanes.
Il n'y a pas que les alcènes dont la formule générale est CnH2n
Les cycloalcanes ont eux aussi cette même formule brute.
Exemple : le cyclohexane de formule C6H12
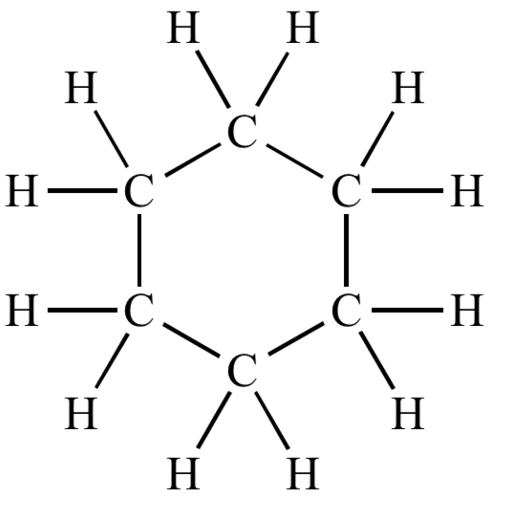
OK ,
Je poursuis ; Le composé obtenu est CnH2nBr2 renfermant 74 % en masse de brome ,le taux de brome est :
CnH2n=C4H8=A
2-2) CH2 = CH - CH2- CH3
CH3-CH=CH-CH3
CH3
|
CH2 = C - CH3
Question 2.1
n = 4 est exact, mais le calcul pour y parvenir ne l'est pas.
Les parenthèses ne sont pas optionnelles !
2 * 80 = 160
Question 2.2 :
C'est bon !
n = 4 est exact, mais le calcul pour y parvenir ne l'est pas.
Je ne vois pas pourquoi
3) Je n'arrive pas à gérer les informations.
Je ne comprends pas bien, moi non plus l'énoncé de la question 3.2
Ce qu'on peut dire :
L'hydratation du but-1-ène conduit à un mélange de deux isomères :
En majorité le butan-2-ol
En moindre quantité le butan-1-ol
L'hydratation du but-2-ène conduit à un alcool unique : Le butan-2-ol
L'hydratation du 2-méthylpropène conduit à un mélange de deux isomères :
En majorité le 2-méthylpropan-2-ol
En moindre quantité le 2-méthylpropan-1-ol
On peut remarquer que l'alcool obtenu préférentiellement par hydratation du but-1-ène est identique à l'alcool obtenu par hydratation du but-2-ène

 CnH2n Br2
CnH2n Br2
