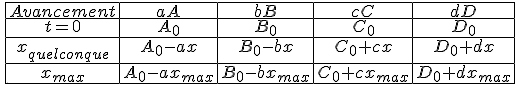Inscription / Connexion Nouveau Sujet
couleur d'une solution
bonjours je voudrais de l'aide s'il vous plais :
les ions cuivre Cu2+ colorent une solution aqueuse en bleu;ils réagissent avec les ions hydroxyde HO-(incolores) pour former un précipité d'hydroxyde de cuivre Cu(OH)2selon l'équation:
Cu2+2HO- Cu(OH)2
Cu(OH)2
on me demande:
a)quel est le réactif limitant lors de la réaction entre 2,0 mol de chaque réactif?
et ensuite:
b) apres filtration au milieu réactionnel ,quelle est la couleur de la solution?
tu as directement la quantité de matière donc enlève juste les x en fonction des coeff stoechiométriques
Tu as une réaction aA + bB = cC + dD
Tu as le tableau général correspondant
Ici tu remplaces par ton énoncé : tu oublie dD
a = 1
b = 2
c = 1
non tu dois garder l'inconnu tant que tu n'as pas déterminé l'avancement maximal xmax
Tu obtiens ceci :
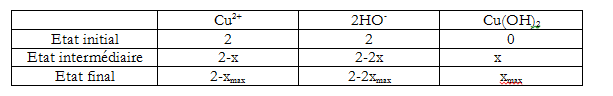
Tu fais une hypothèse :
soit c'est Cu2+ le réactif limitant donc 2-xmax1 = 0. Dans ce cas tu as xmax1 = 2 mol
Soit HO- est limitant et 2-2xmax2 = 0 d'où xmax2 = ? mol
Ensuite tu regardes si c'est xmax1 ou xmax2 le plus grand 
Ok déjà tu as réussi à finir celle-ci ? Tu ne peux pas faire la b) sans connaître le réactif limitant
oui et xmax = 1 mol
Donc à l'état final il te reste 1 mol d'ions cuivriques. Ces ions sont de couleur bleue

 !
!