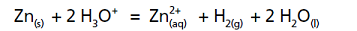Inscription / Connexion Nouveau Sujet
Corrosion des gouttières (Correction )
Salut tout le monde j'aimerai bien qu'on m'aide pour le numeros 5,6 car je bloque sur ces numeros.
Les pluies sont naturellement acides à cause du dioxyde de carbone présent dans l'atmosphère.
De plus, la combustion des matières fossiles (charbon, pétrole et gaz) produit du
dioxyde de soufre et des oxydes d'azote qui amplifient ce phénomène d'acidification.
Lorsque les pluies s'écoulent des toits, elles sont recueillies par des gouttières métalliques
constituées de zinc.
Le zinc est un métal qui réagit en milieu acide selon la réaction d'équation :
Zn + 2 H O = Zn + H + 2 H O (s) 3
+
(aq)
2+
2(g) 2 (l)
On considère le passage de 5 L d'eau acidifiée à raison d'une concentration en ion oxonium
:
[H3O ] = 1,0.10 mol.L
+ -4 -1 sur une gouttière de zinc de masse 500,0 g.
1 De quelle quantité initiale de zinc dispose-t-on ?
2 De quelle quantité initiale d'ions oxonium dispose-t-on ?
3 Construire un tableau de quantité de matière des espèces chimiques, faisant apparaître
l'avancement x.
4 Quel est le réactif limitant ? Justifier la réponse.
5 Quelle masse maximale de dihydrogène peut-on obtenir si le réactif limitant est entièrement
consommé à l'état final ?
6 Quel volume de dihydrogène gazeux cette masse correspond-elle (à 25°C et à la pression
atmosphérique) ?
Données : Masses molaires atomiques (en g.mol-1) : Zn : 65,4 ; H : 1,0.
Volume molaire VM d'un gaz à 25°C et à la pression atmosphérique : 24,0 L.mol-1.
Réponses :
1) 1) Il faut que tu trouve la quantité initiale de zinc
donc n(x)= m(x) / M(x)
- n(x) : quantité de matière en mol.
- m(x) : masse en gramme (m).
- M(x) : masse molaire en g.mol^-1.
500/65,4=7,65mol.
2)n(H3O^(+)=[H3O^(+)]*V=5*10^(-4) mol .
On dispose de 5,0.10-4 d'ions oxonium initialement, étant donné qu'il y a 5 litres d'eau et que la quantité d'ions oxonium pour 1 litre d'eau est de : 1,0 .10-4 .
3) (DESSIN AU - BAS ).
4)Si le zinc est le réactif limitant, alors il est totalement consommé donc n(Zn)i - xmax = 0 alors xmax= n(Zn)i = xmax == 7,65 mol .
Si l'ion oxonium est le réactif limitant alors n(H3O+)i - 2xmax = 0, soit xmax =n(H3O+)i/2 = 5,0 X 10-4/2 = 0,00025 = 25.10-5 mol.
Le réactif limitant est l'ion oxonium car il conduit à la valeur de l'avancement maximal la plus faible, xmax = 25.10-5 mol.
5) Je bloque
6) Je bloque
Merci d'avance.
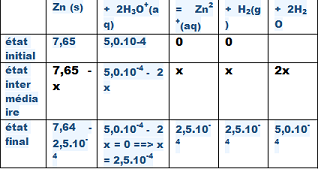
Salut,
Ca veut dirte quoi ça ?:
Zn + 2 H O = Zn + H + 2 H O (s) 3
+
(aq)
2+
2(g) 2 (l)
5) la réaction produit du H2, combien de moles sont prosuites si tu consommes 25.10-5 mol d'ion oxonium?
masse = nbmoles * masse molaire
6) volume = nb moles /* volume molaire
Salut,
25,10-5 * 2=5 c'est doublement faux car:
- 25,10-5 * 2=500.10^-5=5.10^-3
De plus, 25,10-5 * 2 ne permettra pas de trouver le nb de moles de H2
Si tu avais 1 mole de H3O+ combien de moles de H2 obtiendrais tu d'après l'équation bilan?
m(H2)=n(H2)*M(H2)=2.5*10^(-4) gramme
sachant que m(H2)=n(H2)*M(H2)= 2,5*10^(-4) * (2*1,0)= 5*10^(-4).
sachant que m(H2)=n(H2)*M(H2)= 2,5*10^(-4) * (2*1,0)= 5*10^(-4). (celle la )
mais la reponse doit etre m =0,5 mg,peut - tu m'aider a comprende ?
perdu c'est l'autre
Il faut d'abord calculer le nombre de moles de H2 produit
L'équation bilan montre que n(H3O+)/2=n(H2)/1
Or on consomme 25.10-5 moles de n(H3O+),
donc on fabrique 25.10^-5/2=12,5 .10^-5 moles de n(H2)
masse = nbmoles * masse molaire
6) volume = nb moles /* volume molaire
mais pour le 5 sa devient pas m =0,5 mg ?
6) m(H2)=n(H2)*M(H2)= 2,5*10^(-4) * (2*1,0)= 5*10^(-4) g
et bien sur
V=n(H2)*Vm(H2)=2.5*10^(-4)*24000=6.00 cm^3
C'est bon ?
on fabrique 25.10^-5/2=12,5 .10^-5 moles de n(H2)
si on avait 25.10^-5 moles de H2 tes calculs serait juste mais vu qu'on en as que 12,5 .10^-5 moles, tes calculs sont faux
mais comment on doit proceder ? aide moi s'il te plait je bloque vraiment sur ce devoir depuis des jours
L'équation bilan montre que n(H3O+)/2=n(H2)/1 tu comprends ou pas?
Or on consomme 25.10-5 moles de n(H3O+),
donc on fabrique 25.10^-5/2=12,5 .10^-5 moles de n(H2)