Inscription / Connexion Nouveau Sujet
Correction de contrôle : Physique-Chimie
Bonjour !
Pouvez-vous m'aider à corriger un devoir où j'ai eu 10/20, s'il vous plait ?
Je ne comprends pas toujours pourquoi j'ai fait faux.
1- Dissolution de chlorure de baryum dans l'eau
Données : Masses molaires en g.mol-1 :
M(Na) = 23,1 ; M(Cl) = 35,5 ; M(Ba) = 137,3
On dissout une masse m de chlorure de baryum solide BaCl2 (s) dans de l'eau.
1.1 Donner l'équation de dissolution du chlorure de baryum dans l'eau sachant que l'un des ions obtenus est l'ion chlorure Cl-
On veut obtenir un volume V=500,0 mL d'une solution S de chlorure de baryum de concentration molaire C = 2,0 .10-1 mol.L-1
Déterminer la masse m de chlorure de baryum à dissoudre.
Ma réponse : Ca j'ai fait juste.
BaCl2 (s)  2Cl- (aq) + Ba2+ (aq)
2Cl- (aq) + Ba2+ (aq)
Et je trouve la masse m = 21 g
1.2 On veut obtenir un volume V'=500,0 mL d'une solution S' de chlorure de baryum de concentration molaire C' = 1,0 .10-2 mol.L-1
a. Comment s'appelle l'opération à réaliser ?
Ma réponse : On fait une solution fille.
(Le correcteur n'a pas marqué si c'était juste ou pas).
b. Choisir le matériel nécessaire parmi le materiel suivant :
éprouvettes graduées : 10mL 20mL 25mL
pipettes jaugées : 10,0mL 20,0mL 25,0mL
fioles jaugées : 100,0mL 200,0mL 250,0mL 500mL
Ma réponse :
C1V1 = C2V2
V2 = (C1V1)/C2 = 10mL
Il faut :
-Une pipette jaugée de 10,0mL
-2 fioles jaugées dde 500mL (le correcteur m'a barré la réponse)
1.3 Déterminer les concentrations molaires des ions présents dans la solution finale obtenue.
Je n'ai pas fait cette question.
2- La molécule d'eau H20
Données : k = 9,0.109 S.I
Dans la molécule d'eau les liaisons entre les atomes H et O sont polarisées. L'union entre les deux atomes de cette molécule est assurée par un doublet liant d'électrons. Les électrons ainsi "partagés" n'appartiennent plus ni à l'un ni à l'autre des atomes mais aux deux.
Modèle éclaté d'une molécule d'eau :

*** image placée sur l' ***
***
2.1 Dans la molécule d'eau, le doublet liant d'électrons est plus proche de l'atome d'oxygène que de l'atome d'hydrogène. Pourquoi ?
Ma réponse : J'ai eu 0 à cette question. voilà ce que j'ai répondu : L'atome d'oxygène possède 2 électrons sur sa couche externe. Chacun d'eux va se lier à un atome d'hydrogène qui ne possède qu'un électron sur sa couche externe.
Tout se passe comme si l'atome d'hydrogène possédait une charge + centrée sur son noyau et l'atome d'oxygène une charge -2
centrée sur son noyau et l'atome d'oxygène une charge -2 centrée sur son noyau avec
centrée sur son noyau avec  = 5,3.10-20 C.
= 5,3.10-20 C.
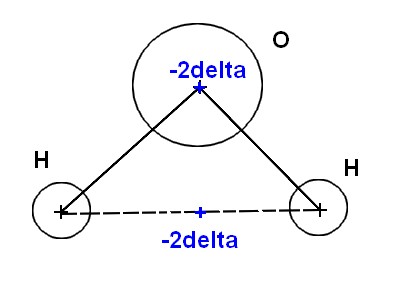
2.2 L'eau est-elle une molécule polaire ? Vous argumenterez votre réponse par un schéma.
Ma réponse : J'ai encore eu 0, voilà ce que j'ai écrit :
Oui, l'eau est une molécule polaire. (là le correcteur m'a demandé : "pourquoi ?".
Voilà mon Schéma : (le correcteur a écrit : "??")
*** image placée sur l' ***
***
2.3 Donner l'expression littérale puis calculer la valeur des forces d'interaction électrique qui s'exercent
a) entre un atome d'oxygène et un atome d'hydrogène.
2) entre deux atomes d'hydrogène.
Ma réponse : Le début j'ai juste :
F = k |qA x qB|
dAB²
k=9,0.109 S.I
qA et qB en Coulomb
dAB en mètre
F en Newton
Et après je me suis trompé sur les calculs car je croyais que 1pm = 1 x 10-6 m alors que 1pm = 1 x 10-12 m.
En refaisant le calcul avec les bonnes conversions je trouve :
a) F = 5,6 x 10-9 N
b) F = 1,1 x 10-9 N
Ce qui parait logique puisque la question suivante est de les tracer sur une annexe avec 1cm pour 1 x 10-9 N.
III - Etude d'un mouvement
Le plus simple c'est que je vous photographie les questions et mes réponses :
questions :
*** image externe supprimée***
réponses :
*** image externe supprimée***
*** image externe supprimée***
Merci de m'aider ! 
Il manque la question 1 sur ma photo :
BaCl2 (s)  Ba2+(aq) + 2Cl-(aq)
Ba2+(aq) + 2Cl-(aq)
Na2SO4 (s)  Na2+(aq) + SO42-(aq)
Na2+(aq) + SO42-(aq)
Le correcteur m'a barré le Na2+(aq)
Pour la suite :
b. Choisir le matériel nécessaire parmi le materiel suivant :
éprouvettes graduées : 10mL 20mL 25mL
pipettes jaugées : 10,0mL 20,0mL 25,0mL
fioles jaugées : 100,0mL 200,0mL 250,0mL 500mL
Ma réponse :
C1V1 = C2V2
V2 = (C1V1)/C2 = 10mL => c'est nécessaire que je fasse ça ?
Il faut :
-Une pipette jaugée de 10,0mL
-2 fioles jaugées de 500mL (le correcteur m'a barré la réponse)
Pourquoi il m'a barré le 500mL ? 
Pour moi, on met 21g de chlorure de baryum dans une fiole jaugées de 500mL et on remplit d'eau distillée jusqu'au trait de jauge.
Ensuite à l'aide d'une pipette jaugée on prélève 10mL de la solution mère obtenue. On met ces 10mL dans une autre fiole jaugée de 500mL et on remplit encore d'eau distillée jusqu'au trait de jauge.
Donc je ne comprend pas pourquoi le correcteur m'a mis faux !
bonjour,
tout d'abord, je voudrais m'excuser, j'ai fais une erreur : l'opération réalisée est une dilution
[la dissolution, c'était juste la question 1.1]
bon après, ne change pas les noms de concentrations et de volumes : pour la solution mère on te disait que V=500ml et C=2,0 .10-1 mol.L-1
et pour la solution fille on voulait que V'=500ml et C'= 1,0 .10-2 mol.L-1
dans ta formule tu as mis : C1V1 = C2V2
donc V2 = (C1V1)/C2
mais qui est C1,V1,C2,V2 ? je pense que C1 et V1 sont la solution mère et C2, V2 la solution fille, mais ne change pas l'énoncé !!! garde C,V,C,V' car sinon on va t'enlever des points...
donc tu cherches à savoir combien il faut prélever de solution dans la solution mère, appelons ce volume V1
donc V1=CV/C'
je t'explique
alors dans l'énoncé on te donne V,C,C',V'
et ta formule te dit que CV=C'V', donc que V=CV/C'
donc déja toi tu as fait une erreur à ce niveau là car tu as fait comme si tu recherchais le volume de solution fille , or on cherhce le volume de solution mère qu'il faut prélever...
ensuite, CV=C'V' avec C, la concentration de la solution mère ; V, le volume à PRELEVER ; C', la concentration de soltuion fille ; et V' le volume que l'on souhaite obtenir
or toi, on te donnait bien C, C' et V' mais pas V, il ne faut pas confondre V (le volume de la solution mère et V(que j'ai appelé V1) le volume de la solution mère qu'il faut prélever...) et dans cette formule, V représente le volume de soltuion mère qu'il faut prélever donc nous avons bien : CV1=C'V' donc V1=C'V'/C
as tu compris ?
ok merci ! 
Donc je trouve V1=0.025 L = 25mL
Donc il faut utiliser une pipette jaugée de 25mL, non ?
Mais après je maintient qu'il faut 2 fioles jaugées de 500mL...
Je ne comprends toujours pas pourquoi ce n'est pas ça.
Une fois que j'ai prélevé les 25mL de S, je les mets dans une fiole jaugées de 500mL, je remplis d'eau distillée et j'ai bien ne solution S' de V'=500,0mL et de concentration molaire C'=1,0.10-2 mol/L, non ?
non il m'a barré le 500mL mais il m'a mis une accolade pour les 2 valeurs en disant que ce n'était pas ça.
Enfin je pense qu'il devait être fatigué et s'est un peu mélanger comme il y avait 2 sujets et dans l'autre il fallait bien trouver 10mL.
Donc à mon avis la bonne réponse est bien :
- une piopette jaugée de 25mL
- deux fioles jaugées de 500mL
Merci kisspeacelove ! 
ba écoute, sauf erreur de ma part, c'est celà.. après c'est bizarre qu'il t'est pas barré le 10mL...
mais si tu as compris ce que je t'ai expliqué, c'est le principal ^^
mais ta correction, il la vérifie ?
oui il va verifier ma correction.
pour la suivante :
1.3 Déterminer les concentrations molaires des ions présents dans la solution finale obtenue.
J'ai essayé de le faire :
BaCl2 (s)  Ba2+(aq) + 2Cl-(aq)
Ba2+(aq) + 2Cl-(aq)
n = C'/V' C' = n x V'
[Ba2+] = (1,0 x 10-2 x 0,5) / 0,5
= 1,0 x 10-2 mol/L
[Cl-] = 2 x (1,0 x 10-2) = 2,0 x 10-2
C'est juste ?
Non mais regarde :
n = C' x V'
Donc en fait C' = n/V' c'est comme dire C' = (C'xV')/V'
(on a remplacé n par C' x V')
Ensuite on peut enlever les V' au numérateur et au dénominateur, ils s'annulent.
Donc la concentration en ions Ba2+ est la même concentration que celle de la solution.
Comme c'est 2Cl-, la concentration est deux fois plus élevée. donc la concentration en Cl- est : 2 x C'
euh ouais... bien pensé ! lol
j'aurais pas fait comme ça, mais c'est sur que si tu n'as pas les quantitées de matières tu es bien obligé(e)
ton raissonnement me parait juste 
ok merci. Au fait, je suis un garçon 
2.1 Dans la molécule d'eau, le doublet liant d'électrons est plus proche de l'atome d'oxygène que de l'atome d'hydrogène. Pourquoi ?
Franchement j'en sais rien ! 
2.2 L'eau est-elle une molécule polaire ? Vous argumenterez votre réponse par un schéma.
L'eau est une molécule polaire car ls barycentres de charges positive et négative ne convergent pas.
Et je ne vois pas pourquoi mon schéma ne lui plaît pas.
On avait pourtant fait quelque chose de similaire en cours.(cétait un devoir commun et ce n'est pas mon prof qui m'a corrigé).
ok, cher garçon lol
alors là, je suis désolée (je suis une fille lol) je ne peux pas t'aider car tout simplemennt, ce chapitre là quand on l'avait fait, j'étais absente, j'avais rattrapé le cours mais je n'avais rien compris... j'avais demandé au prof de me réexpliquer et il m'avait légérement envoyé bouller...
donc voilà désolée lol
mais ce n'est pas une histoire avec des delta positifs et des delta négatifs par hasard ?


