Inscription / Connexion Nouveau Sujet
Concentration et Spectrophotomètrie
Bonjour,
J'ai un DM à faire en Physique chimie mais je bloque dès la première question : Donc pouvez vous m'aider tout en m'expliquant
Merci d'avance
TOUS LES DOCUMENTS SONT EN DESSOUS
---------------------------------
Le but de exercice est d'illustrer le dosage d'une solution notée Sª utilisée en hydrométallurgie, et contenant des ions cuivre
(II): Cu²+ (ag).
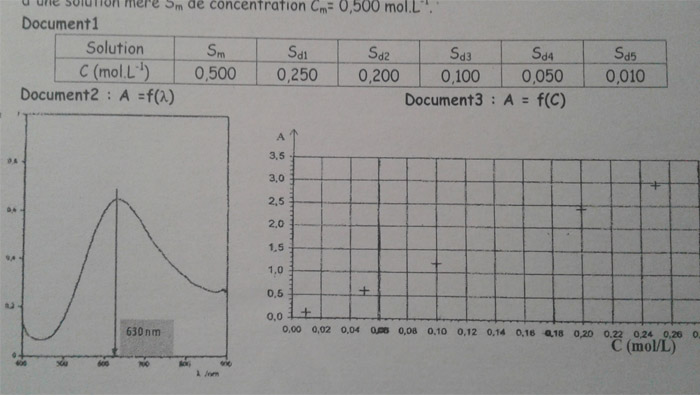
Pour cela, on prépare un ensemble de solutions de sulfate de cuivre (Cu²+ (aq) + so4²- (aq)) à partir d'une solution mère Sm de concentration Cm: 0,500 mol/L
1) Quel volume de la solution mère a -t-il fallu prélever pour préparer 50.0 mL de la solution, Sd2, argumenter.
Préciser la verrerie utilisée pour effectuer le prélèvement et pour préparer la solution Sd2
2) Mesure de l'absorbance de chacune des solutions avec un spectrophotomètre.
a) A quelle longueur d'onde devra-t-on régler le spectrophotomètre et pourquoi?
b) On mesure l'absorbance des solutions préparées. Les points expérimentaux sont présentés sur le graphique A = f(C). En déduire si la loi de Beer-Lambert est vérifiée et donner la formule. Justifier
3) On prélève 25.0 mL de la solution Sª que l'on introduit dans une fiole Jaugée de 50,0 mL dont on complète le niveau avec de l'eau distillée. Après homogénéisation l'absorbance de cette solution Sb est mesurée A = 1,5
a) Déterminer graphiquement la concentration de la solution SE.
b) En déduire celle de la solution Sª. Justifier.
4) En réalité, la solution Sª a été préparée par dissolution d'une masse m1: 15,6 g de sulfate de cuivre pentahydraté solide de masse molaire M1=249,6 g/mol afin de préparer un volume de 250,0 mL de solution. Déterminer la concentration de cette solution
Est-ce conforme au résultat obtenu par dosage ?