Inscription / Connexion Nouveau Sujet
Composés aromatiques
Bonsoir aidez moi svp ,je suis bloqué sur ce sujet
1)Quel est l'hydrocarbure aromatique dont la masse molaire vaut 92 g/mol. Quel est son nom
2)Un hydrocardure de masse molaire 106 g/mol possede un noyau aromatique.Déterminer sa formule brute et les formules semi-developpées possibles.Nommer ces isomeres obtenus
Bonsoir
Montrer que la formule générale d'un hydrocarbure ne portant pas d'autre insaturation que celle du noyau aromatique est C(6+n) H(6+2n)
n étant le nombre d'atomes de carbone situés en dehors du cycle.
Tu peux regarder un hydrocarbure aromatique comme étant une molécule de benzène à laquelle on a retiré un atome d'hydrogène pour lui substituer un radical alkyl
S'il est monosubstitué:On a
C6H5-CnH2n+1 de formule brute C(6+n)H(6+2n)
S'il est disubstitué :On a
C6H4-CnH2n+2 de formule brute C(6+n)H(6+2n)
Et s'il est trisubstitué: On a
C6H3-CnH(2n+3) de formule brute C(6+n)H(2n+6)
Sinon ,avec cette formule ,on a
M(C6+n)H(6+2n)= 92 <=> 78+14n=92 <=> n=1
Donc la formule brute est C7H8
2) On a
M(C(6+n)H(6+2n))=106<=> 14n=24 <=>n=2
La formule brute est C8H10
Formules S D:
C6H5-C2H5 : éthylbenzene
La formule ne marche pas pour les molécules de formule C8H8 ;C14H10 ;C14H12; C14H14.....
J'ai précisé (03-03-20 à 00:26) que la formule C(6+n)H(6+2n) ne concerne que les hydrocarbures aromatiques ne portant pas d'autres insaturations que celle du noyau aromatique.
En d'autres termes :
Pour un hydrocarbure aromatique monocyclique et sans liaisons multiples en dehors du cycle la formule générale peut s'écrire C(6+n)H(6+2n)
n étant le nombre d'atomes de carbone situés en dehors du cycle.
Remarque : Peu importe que le composé étudié soit mono ou polysubstitué car la formule C(6+n)H(6+2n) reste la même.
-La molécule ne peut être trisubstitué car elle ne possède que 8 atomes de carbone
-Si elle est disubstitué ,la tétravalence de l'un des atomes de carbone n'est pas respectée
-Et si elle est monosubstitué, je ne vois qu'une seule possibilité
-Si elle est disubstitué ,la tétravalence de l'un des atomes de carbone n'est pas respectée
J'ai pourtant trouvé trois diméthylbenzène respectant la tétravalence de tous les atomes de carbone.
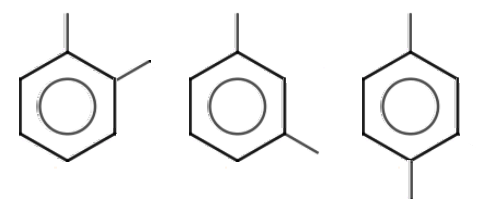
1) ah je vois ,je me suis fié à C2H5 pour le cas où il est disubstitué ,alors que c'est C2H6
On a CH3-C6H4-CH3 : orthodiméthylbenzene
CH3-C6H4-CH3 : métadiméthylbenzene
CH3-C6H4-CH3 : paradiméthylbenzene


