Inscription / Connexion Nouveau Sujet
Combustion cétone
On fait subir à une cétone de formule brute CnH2nO une combustion complète. Pour brûler 0,2 mol de
cette cétone, il faut utiliser 40,8 litres de dioxygène.
1 - Ecrire l'équation de la réaction qui traduit la combustion complète de cette cétone. On rappelle que
lors d'une combustion complète, il ne se forme que du dioxyde de carbone et de l'eau.
J'ai mis : CnH2nO + (2n+n-1)/2 O2 => nCO2 + nH2O
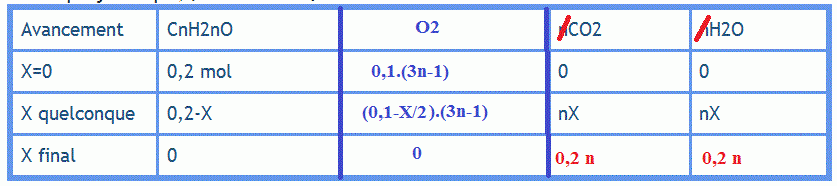
2 Dresser le tableau d'avancement de la réaction et montrer que n est égal à 6.
C'est là que je bloque, pour l'instant j'ai mis :
| Avancement | CnH2nO | nCO2 | nH2O |
| X=0 | 0,2 mol | 0 | 0 |
| X quelconque | 0,2-X | nX | nX |
| X final | 0 | ? | ? |
Les données : Masses atomiques en g.mol−1 : H = 1 ; C = 12 ;
O = 16
Volume molaire des gaz dans les conditions de
l'expérience : 24 L.mol-1
bonjour
tu as oublié ,dans ton tableau,(3n-1)/2 O2
puisque la combustion est totale xmax=0,2 mol
calcule la qté de O2 initiale.
à la fin de la combustion n(O2)=0 donc n(O2)i-(3n+1)/2*xmax=0
en résolvant on trouve n=6
Je suis désolé mais je ne comprend pas trop ce que tu veux dire, il vient d'où le i dans la formule n(o2)i-(3n-1)/2*xmax=0 ?