Inscription / Connexion Nouveau Sujet
Classification quantitative des couples ion métallique/métal n°1
Bonjour
J'aurais besoin d'aide pour cet exercice:
L'énoncé: (et merci de corriger l'énoncé car je l'ai textuellement recopié sans changer rien !)
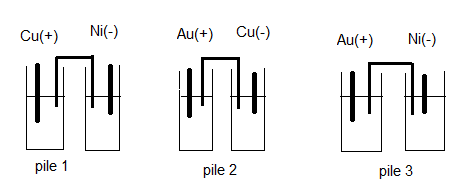
On considère les 3 piles ci-dessous:
Les piles (I) et (2) sont montées en série ,la f.e.m de l'association est 1,73 V .Les piles (1) et (2) sont montées en opposition ,la f.e.m l'association est 0,55V .
1. Trouver les f.e.m possibles des piles (1) et (2) .
2. Trouver la f.e.m de la pile (3). En déduire la f.e.m exacte des piles (1) et (2)
3. La pile faisant intervenir les couples H3O+/H2 et Au3+/Au a une f.e.m de 1,5 V .Trouver les potentiels rédox des couples Au3+/Au, Cu2+/Cu et Ni2+/Ni
Salut beugg.
Ce n'est pas un exercice très intéressant, il demande plus de calculs que de connaissances...
Je me lance quand même.
La seule connaissance utile est celle ci, pour une pile, on a : E =  (borne +) -
(borne +) -  (borne -)
(borne -)
Pour la pile 1, on aura donc : E1 =  (Cu2+ / Cu) -
(Cu2+ / Cu) -  (Ni2+ / Ni)
(Ni2+ / Ni)
Pour la pile 2, on aura donc : E2 =  (Au3+ / Au) -
(Au3+ / Au) -  (Cu2+ / Cu)
(Cu2+ / Cu)
Pour l'association en série (Pile 1 ; Pile 2), on a : Esérie = E1 + E2 = 1.73 V
En remplaçant par les expressions précédentes, on a :
[ (Cu2+ / Cu) -
(Cu2+ / Cu) -  (Ni2+ / Ni)] + [
(Ni2+ / Ni)] + [ (Au3+ / Au) -
(Au3+ / Au) -  (Cu2+ / Cu)] = 1.73 V
(Cu2+ / Cu)] = 1.73 V
En effectuant,  (Cu2+ / Cu) disparaît et on obtient :
(Cu2+ / Cu) disparaît et on obtient :
 Esérie = -
Esérie = -  (Ni2+ / Ni)] +
(Ni2+ / Ni)] +  (Au3+ / Au) = 1.73 V
(Au3+ / Au) = 1.73 V
soit encore :  (Au3+ / Au) -
(Au3+ / Au) -  (Ni2+ / Ni)] = 1.73 V
(Ni2+ / Ni)] = 1.73 V
Cette valeur représente la fém de la pile 3.
Pour l'association en opposition (Pile 1 ; Pile 2), on a : Eopposition = E1 - E2 = 0.55 V ou Eopposition = E2 - E1 = 0.55 V
En reprenant les valeurs de l'association en série, on a donc deux systèmes d'équations possibles...
-1° hypothèse :
E1 + E2 = 1.73 V
E1 - E2 = 0.55 V
En ajoutant membre à membre, on obtient : 2 E1 = 2.28 V  E1 = 1.14 V et E2 = 1.73 - E1 = 0.59 V
E1 = 1.14 V et E2 = 1.73 - E1 = 0.59 V
-2° hypothèse :
E1 + E2 = 1.73 V
E2 - E1 = 0.55 V
En ajoutant membre à membre, on obtient : 2 E2 = 2.28 V  E2 = 1.14 V et E1 = 1.73 - E2 = 0.59 V
E2 = 1.14 V et E1 = 1.73 - E2 = 0.59 V
Comme la fém de la pile 3 est (voir plus haut) : E3 =  (Au3+ / Au) -
(Au3+ / Au) -  (Ni2+ / Ni) = 1.73 V
(Ni2+ / Ni) = 1.73 V
on voit que :  (Au3+ / Au) -
(Au3+ / Au) -  (Ni2+ / Ni) > 0
(Ni2+ / Ni) > 0
De même : pour la pile 1, E1 =  (Cu2+ / Cu) -
(Cu2+ / Cu) -  (Ni2+ / Ni) = 1.73 V
(Ni2+ / Ni) = 1.73 V 
 (Cu2+ / Cu) -
(Cu2+ / Cu) -  (Ni2+ / Ni) > 0
(Ni2+ / Ni) > 0 
 (Cu2+ / Cu) >
(Cu2+ / Cu) >  (Ni2+ / Ni)
(Ni2+ / Ni)
De même : pour la pile 2, E2 =  (Au3+ / Au) -
(Au3+ / Au) -  (Cu2+ / Cu) = 1.73 V
(Cu2+ / Cu) = 1.73 V 
 (Au3+ / Au) -
(Au3+ / Au) -  (Cu2+ / Cu) > 0
(Cu2+ / Cu) > 0 
 (Au3+ / Au) >
(Au3+ / Au) >  (Cu2+ / Cu)
(Cu2+ / Cu)
En récapitulant, on peut donc classer les potentiels rédox des 3 couples :
 (Au3+ / Au) >
(Au3+ / Au) >  (Cu2+ / Cu) >
(Cu2+ / Cu) >  (Ni2+ / Ni)
(Ni2+ / Ni)
La borne positive de l'association en opposition sera donc la lame d'or 
Eopposition = E2 - E1 (2° hypothèse) et donc : E2 = 1.14 V et E1 = 0.59 V
Pour la dernière question, on sait que par convention,  (H3O+ / H2) = 0.00 V
(H3O+ / H2) = 0.00 V  pour la pile Au3+/Au | H3O+ / H2, on peut écrire : E =
pour la pile Au3+/Au | H3O+ / H2, on peut écrire : E =  (Au3+/Au) -
(Au3+/Au) -  (H3O+ / H2) = 1.5 V
(H3O+ / H2) = 1.5 V 
 (Au3+/Au) = 1.5 V
(Au3+/Au) = 1.5 V
Pour la pile 3 : E3 =  (Au3+ / Au) -
(Au3+ / Au) -  (Ni2+ / Ni) = 1.73 V
(Ni2+ / Ni) = 1.73 V 
 (Ni2+ / Ni) =
(Ni2+ / Ni) =  (Au3+ / Au) - 1.73
(Au3+ / Au) - 1.73
soit  (Ni2+ / Ni) = 1.5 - 1.73 = - 0.23 V
(Ni2+ / Ni) = 1.5 - 1.73 = - 0.23 V
Pour la pile 2 : E2 =  (Au3+ / Au) -
(Au3+ / Au) -  (Cu2+ / Cu) = 1.14 V
(Cu2+ / Cu) = 1.14 V 
 (Cu2+ / Cu) =
(Cu2+ / Cu) =  (Au3+ / Au) - 1.14
(Au3+ / Au) - 1.14
soit  (Cu2+ / Cu) = 1.5 - 1.14 = 0.36 V
(Cu2+ / Cu) = 1.5 - 1.14 = 0.36 V
Je n'ai rien relu et j'ai pas mal utilisé le "copié-collé", j'espère ne pas avoir fait d'erreurs !!!




