Inscription / Connexion Nouveau Sujet
chimie
bonjour tout le monde
j'ai un petit exo dont j'ai eu quelques difficultés donc je vous pris de bien m'aider
Deux récipients sont relués par un tube de volume négligesble muni d'un robinet . les deux récipients contiennent un gaz parfait 0. la température de 27degrès celsus ne varie pas pendant l'experience .
la pression P1 = 2×105 Pa et V1 = 2L
la pression P2 =1×105 Pa et V2=5L
on donne R=8,31 (S.I) la constante du gaz .
1) calculer les quantités de matière n1 et n2 de gaz parfait dans chaque récipient .
reponce :
n1 = 0,017×10-5 mol
n2 = 0,022×105 mol
2)on ouvre le robinet . en déduire le volume total Vt occupé par le gaz .
merciiiiiiii d'avanccee
Bonjour,
Tes réponses sont fausses.
Il te faut appliquer la loi des gaz parfaits en faisant attention aux unités :
- La pression en Pascal
- Le Volume en m3
- La température en Kelvin
ah ok j'ai commpris et pour la dezieme question ???
Elle me semble d'une simplicité enfantine.
Les deux gaz se mélangent et occupent la totalité de la place qui leur est offerte.
Tu peux donc calculer Vt
Il est très simple de dire :
" j'ai pas compris comment faire".
Je ne m'en contente pas.
J'attends donc de savoir ce que tu ne comprends pas, soit en proposant une solution, soit en posant des questions précises.
Voici un schéma de la situation pour t'aider :
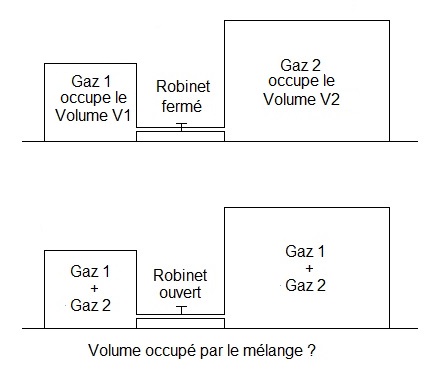
Bonjour,
PV=nRT
Deux récipients sont relués par un tube de volume négligesble muni d'un robinet . les deux récipients contiennent un gaz parfait 0. la température de 27degrès celsus ne varie pas pendant l'experience .
la pression P1 = 2×105 Pa et V1 = 2L n1=0.160319mol a trois chiffres: 1.60 *10^-1mol
la pression P2 =1×105 Pa et V2=5L n2=0.2004613 mol a trois chiffres : 2.00*10^-1 mol
on donne R=8,31 (S.I) la constante du gaz .
1) calculer les quantités de matière n1 et n2 de gaz parfait dans chaque récipient .
reponce :
n1 = 0,017×10-5 mol
n2 = 0,022×105 mol
2)on ouvre le robinet . en déduire le volume total Vt occupé par le gaz . ![]()
Mélange de gaz parfaits![]()
***Raccourcis url ajoutés***






