Inscription / Connexion Nouveau Sujet
chimie
bonjour.
comment trouve t'on la valeur de l'avancement maximal d'un système chimique ?
merci.
equation de la réaction : Mg + 2(H+(aq) + Cl- (aq)  Mg2+ + H2 .
Mg2+ + H2 .
il y a 0,041mol de magnesium et 0,05mol d'acide chlorhydrique .et sa me dit qu'elle sera le réactif limitant puis qu'elle est la valeur de l'avancement maximal .
pour l'équation , le 2 que j'ai mit en produit ben c'est moi qui la rajouter.
ouais . fin je les fait pour la question précédente qui me disait faire le tableur dans un cas générale mais pour celle la ils ne le demande pas mais le réactif limitant j'ai mit que se serait le magnesium et j'ai dit qu'il y aurer que 1 étape ?
comment ??
parce que pour trouver le réactif limitant il faut faire une équation .
et pour savoir qu'elle la quantité de matiere que l'on enlève à chaque étapes comment on fait ?
oui biensure .
Mg = 24g.mol et il i a 1g donc n = 1/24 = 0,041 mol et de l'acide il y a : n=c v =1
v =1 0,05= 0,05
0,05= 0,05
donc le réactif limitant est : le Mg car il est en quantité inférieur face à l'acide .
4,1 10-2-Xmax =0
10-2-Xmax =0 Xmax=4,1
Xmax=4,1 10-2.
10-2.
voila ce que j'ai mit .
attention les proportions ne sont pas "1-1"
regarde le cas général pour une réaction aA + bB ---> cC + dD
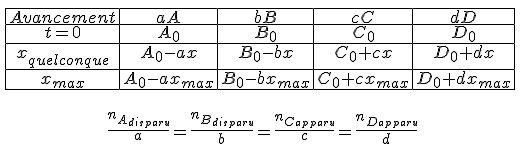
a ok merci .
mais avec les nombre dans la ligne x quelconque moi je met la quantité de matiere - x et voila.
mais tu voix dans le tableau à la premiere etape faux bien retiré une quantiter de matiere ben il faux retirer combien pour mon cas a moi?
Mg + 2H+(aq) ---> Mg2+(aq) + H2 .
Mg = 24g.mol et il i a 1g donc n = 1/24 = 0,041 mol et de l'acide il y a : n=cv =10,05= 0,05
donc le réactif limitant est : le Mg car il est en quantité inférieur face à l'acide .
4,110-2-Xmax =0 Xmax=4,110-2.
n(Mg)initial = 4,1.10-2 mol
n(H+)initial = 5,0.10-2 mol
Donc à l'état final tu as n(Mg)initial - xmax1 = 0 <=> xmax1 = 4,1.10-2 mol
n(H+)initial - 2xmax2 = 0 <=> xmax2 = 5,0.10-2/2 = 2,5.10-2 mol
Donc le réactif limitant est l'ion H+
tu as deux moles de dihydrogène qui réagissent voilà pourquoi.
Ce sont des xmax théoriques.
Et le xmax de ta réaction c'est xmax2 en l'occurence
c'est juste une notation. Tu as une sorte de système d'équation, je ne pouvais pas appeler les deux xmax
nous on met plusieurs fois le même .
et dans mon tableu comme ils me dise les ion chlorure sont spectateur donc c'est pa grave si j'ai mit :2(H++Cl-) ?
ouais enfin personnellement je n'aime pas...
n(Mg)initial = 4,1.10-2 mol
n(H+)initial = 5,0.10-2 mol
Donc à l'état final tu as n(Mg)initial - xmax = 0 <=> xmax = 4,1.10-2 mol
n(H+)initial - 2xmax = 0 <=> xmax = 2,5.10-2 mol
Voilà
Ah oui j'avais zappé la deuxième partie : si tu mets les ions chlorures dans les réactifs, il les faut dans les produits
Mg + 2H+(aq) ---> Mg2+(aq) + H2
ou
Mg + 2(H+ + Cl-)(aq) ---> Mg2+(aq) + H2 + Cl-(aq)
Lavoisier a dit : rien ne se perd, rien ne se crée, tout se transforme 
Si tu as du chlorure dans les réactifs tu en as dans les produits
a ok .
mais l'acide chlorhydrique c'est : (H++Cl-) donc le Cl ont le met sinon ce n'est plus de l'acide.
merci quand meme parce que franchement tes patiente tu repond au question et sa gratuitement  donc merci beaucoup .
donc merci beaucoup .
d'ailleurs j'ai fait une erreur : Mg + 2(H+ + Cl-)(aq) ---> Mg2+(aq) + H2 + 2Cl-(aq)
(sinon il manque un ion chlorure dans les produits)
et les propriétés acide d'un solution sont données par l'ion H+, tout comme les propriétés basiques sont données par l'ion OH-
non c'est bon 
demain je pense que je vais faire des exercice en chimie sur ce chapitre donc on vera autant je poserais des question si j'ai pas comprit  . merci
. merci
a oui je voulais te demander si tu connaissais un site ou il y a des exercice de chimie avec les corrigés ?
salut .
pour la fonction recherche du site sa me donne des topic au lieu de me donner des exercices.
j'ai un calcule à faire je connais le resultat mais je n'arrive pas à le faire sans calculette donc si tu pouvais me donner les résultats sa serais bien  : 2,0
: 2,0 10-2-3Xmax.
10-2-3Xmax.
Xmax = 5 10-3 .
10-3 .
et c'est les puissances qui me gène .
oué mais en faite quand je me suis entrainer à le refaire ben j'arrive pas à trouver le bon résultat c'est pour sa que je te demande de me dire comment on fait 
en faite Xmax = 5 10-3
10-3
n'oublie pas l'unité, c'est en mol.
Dans ce cas c'est ce que tua s écrit hier à 18h38, tu remplaces xmax par sa valeur dans le calcul.
Il te faut le faire à la main ou à la calculatrice?


