Inscription / Connexion Nouveau Sujet
chapitre
Bonjour,
Alors voila, j'ai un exercice à faire mais je ne comprend pas vraiment le sens...
Voici l'énoncé :
"La grande nébuleuse d'Orion comporte quatre étoiles très chaudes qui émettent un rayonnement riche en ultraviolets au sein d'un nuage de gaz interstellaire constitué en majorité d'atomes d'hydrogène.
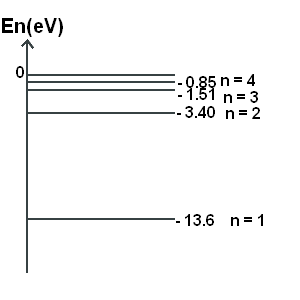
Le diagramme présente les deux premiers niveaux d'énergie de l'atome d'hydrogène. Ici, le niveau d'énergie 0 est celui pour lequel l'électron devient indépendant du noyau. Avec cette origine, les énergies de l'atome sont négatives. Lorsque le noyau et les électrons sont séparés, c'est à dire lorsque l'atome est ionisé, les énergies sont positives et elles ne sont pas quantifiées.
a) Pour quelle raison le rayonnement de ces quatre étoiles est-il riche en ultraviolets ?
Par ce que les énergies sont négatives ?
b) Quelle est l'énergie minimale d'un photon susceptible d'ioniser un atome initialement dans son état fondamental ?
Je n'ai pas compris la question.
c) Quelle est la longueur d'onde  de la raditation correspondante ? Dans quel domaine des ondes lumineuses se situe-t-elle ?
de la raditation correspondante ? Dans quel domaine des ondes lumineuses se situe-t-elle ?
J'ai besoin de la question b) pour répondre...
d) Un atome d'hydrogène dans l'état fondamental peut-il être excité par une radiation de longueur d'onde  ' = 110 nm.
' = 110 nm.
Un atome ionisé c'est un atome excité ou non ?
Si c'est le cas la réponse est oui car 110 nm ce sont les ultraviolets, mais si ce n'est pas le cas la réponse est non vu que les énergies sont positives.
e) Sous l'effet du rayonnement UV reçu, le gaz de la nébuleuse est partiellement ionisé. Les électrons se recombinent avec des noyaux d'hydrogène pour former des atomes excités qui se désexcitent progressivement avec émission de photo. Quelle est la longueur d'onde de la raditation émise lors de la transition des atomes d'hydrogène du niveau 3 au niveau 2.
- 3.40 - (-1.51) = -3.40 + 1.51 = -1.89
La longueur d'onde de la radiation est de 189 nm."
Je ne suis pas du tout sûre de mes réponses.
Merci d'avance à ceux qui m'aideront 
salut  !
!
a) justifie davantage
b) as-tu compris le chapitre? sais-tu à quoi correspond le diagramme? comment un atome est-il ionisé?
Bonjour lilou533 !
A — La réponse est dans cette phrase "Lorsque le noyau et les électrons sont séparés, c'est à dire lorsque l'atome est ionisé...". Que subissent les électrons d'hydrogène ? Quelle en est la conséquence ?
B — L'état fondamental est caractérisé par n = 0. L'ionisation signifie que ton électron va s'échapper du noyau. Quelle est l'énergie photonique nécessaire pour que l'électron passe de l'état fondamental à son extraction ?
C — Tu as maintenant la réponse à la question B. Déduis-en la longueur d'onde d'ionisation.
D — Un atome ionisé est un atome qui a perdu un électron. L'hydrogène excité est un atome dont l'électron est passé d'un état fondamental à un autre niveau n, NUANCE !. Pour connaitre la réponse à la question, calcule l'énergie donnée par un photon s'il excite l'atome à 110 nm. Qu'en déduis-tu ?
Pour la suite on verra après. Réfléchis déjà jusque-là.
salut  !
!
a) KingFrieza a tout dit. Il s'agit d'ionisations
c) tu as une formule dans ton cours qui te permet de déduire la longueur d'onde
d) tu as fait le calcul ?
c) la formule que j'ai est lambda = C / nu . Mais il me manque nu pour pouvoir calculer après si je me suis tromper de formule merci de me le dire .
d) Je sus tombée sur 7.293*10^-32 J avec la formule E=h * la fréquence de la radiation
Merci
Salut  !
!
lolita ---> ok pour la d), la formule est correcte je te fais confiance pour l'application numérique.
que désigne nu ? reprends la définition 
Paris ---> L'ionisation est l'action qui consiste à enlever ou ajouter des charges à un atome ou une molécule. L'atome (ou la molécule) perdant ou gagnant des charges n'est plus neutre électriquement. Il est alors appelé ion. (Wikipédia)
L'énergie d'ionisation d'un atome ou d'un ion est l'énergie minimale à fournir pour soustraire complètement un électron à cet atome (ou ion), pris à l'état gazeux.
je vois pas comment faire avec ce résultat pour répondre à la question Peut -on me dire comment faut-ils faire ??
Merci d'avance
Paris ---> je t'en prie, si tu as d'autres questions 
Lolita ---> tu as d'autres définitions de lambda
salut j'ai cette exercice a faire pour la rentrer et je suis bloqué sur la question c)
quelqu'un pourraient me dire la fréquence v en Hz ou fréquence nu car c la seul question ou je suis bloqué
merci d'avance
Quelqu'un pourrait réexpliquer pour les question c,d et e svp ? je suis vraiment perdu
car je ne vois pas ou il y a les mesures etc pour faire les calculs
Bonsoir,
c) Tu dois calculer la longueur d'onde correspondant à l'énergie que tu a trouvé dans la question précédente, pour cela tu dois utiliser la formule ΔE= h*c/λ que tu transformes en λ= (c*h)/ΔE (avec ΔE en J, c en m/s, λ en m) et en remplaçant ΔE par le résultat trouvé à la question b.
e) Tu dois d'abord calculer la valeur de l'énergie échangée par l'atome d'hydrogène au cours de la transition des niveaux 3 à 2, puis avec cette valeur et toujours la même formule qu'à la question c tu peux trouver la longueur d'onde.
Pour la d tu dois calculer l'énergie du photon quand lambda= 110 nm (n'oublie pas de le convertir en mètre). Tu peux en déduire la réponse à la question grâce au résultat.
Salut !
Est ce que quelqun pour raíz m'expliquer comment repondre a la que satino a.
Merecí d'avance
Pour la question aje croit qu il faut dir que les atomes sont ionise. Mais comment je peut le justifier et l expliquer un peu ?
Merci d avance
salut  !
!
A — La réponse est dans cette phrase "Lorsque le noyau et les électrons sont séparés, c'est à dire lorsque l'atome est ionisé...". Que subissent les électrons d'hydrogène ? Quelle en est la conséquence ?
arrête de poster 50 fois à la suite sinon on ne voit plus rien. Laisse moi deux minutes pour répondre tu n'es pas le seul à réclamer de l'aide...
Sais-tu ce qu'est une ionisation ? C'est dit dans la première partie de la phrase. Dans ce cas les électrons sont indépendants du noyau ---> niveau d'énergie 0 d'où le fait que les énergies ne soient pas quantifiables
oui, je sais ce qu'est une ionisation, ce que je ne comprend pas et comment répondre à la question en dissons "c'est une ionisation"
ce que je veut dire ce que je comprendre le terme ionisation cependant je ne sias pas à quoi sert pour expliquer des rayonnements ultraviolets
ok, donc pour répondre à la question a. je doit dire qu: on sait que l'atome est ionisé deplues étant donné que les nuages sont riches en hydrogène, elle émettent des rayonmments ultraviolets.
c'est un peut incohérent et pas justifier, non ?
faudrait que tu justifies davantage par rapport à tout ce que je t'ai dit (déjà détaille un peu plus l'ionisation)
Merci
a. Le rayonement de ces qatres etoiles est Riche en ultraviolets car la nebuleuse est compose d'atomes d'hydrogene. Ces atomes sont dans un etat excite, anisi lis int des energies negatives. On peut donc en deduire que les radiations emisses vont etre Audi ineferieur dond des UV
C'est juste?
Merci d'avance



