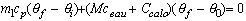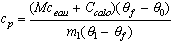Inscription / Connexion Nouveau Sujet
Calorimétrie
Bonsoir,
J'ai un exercice de PCL, qui est le suivant :
Dans un ensemble calorimètre et accessoire de capacité calorifique K = 100 J.K-1.
On introduit une masse m : 200 g d'eau de chaleur massique c : 4,19.10puissance3 J.k-1.K-1 la temperature est alors téta1 : 25 °C.
On ajoute un galçon de m2 : 20 g sorti du congélateur à la température téta2 : -18 °C. La chaleur massique de la chaleur massique c2 de la glace d'eau c2 : 2,1.10puiss3 J.kg-1.K-1 et enfin la chaleur de la fusion Lf : 3,3.10puiss5 J.kg-1.
La question à faire est d'exprimer les formules en lettres sachant qu'on a déjà commencé l'exercice en faisiant à peu près ça :
m1 d'eau liquide m2 de glace calorimètre + accessoire
téta1 : 25 °C téta2 : -18 °C téta1 : 25 °C
↓ Q2 ↓ ↓ Q1
↓ Q3 ↓
m1 d'eau liquide m2 de glace à 0 °C
↓ Calorimètre +
Q3 accessoire
m2 d'eau à 0 °C
↓
Q3
Etat d'equi. Tétaf
m2 d'eau liquide
Désolé pour le téta, je n'arrive pas à le faire, ça ne marche pas pour le degré Celsius.
Voilà, merci à celle ou à cleui qui peut m'éclairer à ce sujet.
Bonjour,
Pour faire un  : tu cliques sur le bouton
: tu cliques sur le bouton  qui se trouve au bas du rectangle dans lequel tu écris (au-dessus de "POSTER" et de "Aperçu") et tu cliques sur le
qui se trouve au bas du rectangle dans lequel tu écris (au-dessus de "POSTER" et de "Aperçu") et tu cliques sur le  : cela place dans ton texte [ smb]theta[ /smb] et tu peux vérifier avec l'Aperçu que c'est bien un
: cela place dans ton texte [ smb]theta[ /smb] et tu peux vérifier avec l'Aperçu que c'est bien un  qui s'affiche. Pratique, non ?
qui s'affiche. Pratique, non ?
Il faut écrire que la quantité de chaleur perdue par le calorimètre, ses accessoires et l'eau initialement introduite entre la température initiale ( 1 = 25 °C) et la température finale
1 = 25 °C) et la température finale  f est égale à la quantité de chaleur gagnée par le glaçon entre son introduction dans le calorimètre à la température
f est égale à la quantité de chaleur gagnée par le glaçon entre son introduction dans le calorimètre à la température  2 = -18 °C et la même température finale
2 = -18 °C et la même température finale  f.
f.
Le seul problème serait de savoir si glaçon fond ou non. Mais il serait improbable quand même qu'un glaçon de 20 grammes parviennent à faire geler une masse d'eau de 200 grammes, sans compter le calorimètre. Donc tu peux sans crainte faire l'hypothèse que c'est le glaçon qui fond et non pas l'eau du calorimètre qui gèle.

Désolé au fait que le tableau ne soit pas sorti car je l'ai fait avec Word et j'espère que tu as compris.
Expliquez moi ce qu'il faudrait chercher, le seul problème est que je n'ai pas compris ce que la prof a dit au sujet d'exprimer Q1, Q2 et Q3 ?
Si c'est la température de l'eau qu'il faut chercher à la fin, j'ai trouvé 22.18 °C.
Il y a plusieurs possibilités et je ne sais pas ce que ton professeur a appelé Q1, Q2 et Q3
Je te propose d'en calculer 5 ! ...  et de regrouper ensuite selon les consignes de ton professeur. Pour ne pas les confondre on va les noter avec un q minuscule
et de regrouper ensuite selon les consignes de ton professeur. Pour ne pas les confondre on va les noter avec un q minuscule
q1 = quantité de chaleur perdue (elle est négative) par le calorimètre et ses accessoires en passant de  1 à
1 à  f
f
q2 = quantité de chaleur perdue (elle aussi est négative) par l'eau initialement présente dans le calorimètre en passant de  1 à
1 à  f
f
q3 = quantité de chaleur gagnée (elle est positive) par le glaçon en passant de  2 à 0 °C
2 à 0 °C
q4 = quantité de chaleur gagnée (elle est aussi positive) par le glaçon en passant de glace à 0 °C à de l'eau à 0 °C (la fusion du glaçon)
q5 = quantité de chaleur gagnée (positive) par l'eau provenant du glaçon fondu en passant de 0 °C à  f
f
Je te fais la première :
q1 = K.( f -
f -  1)
1)
et je te fais aussi la cinquième
q5 = m2.c.( f - 0)
f - 0)
et comme ceci il t'en reste encore 3 à faire 

Voilà je viens de finir les 5 formules et je voulais savoir si tu pouvais me rectifier si des erreurs sont présentes :
q1 = K.( f-
f- 1)
1)
q2 = m1.( f-
f- 1)
1)
q3 = m2.(0- 2)
2)
q4 = m2.( 1-
1- 2)
2)
q5 = m1.( f-m2)
f-m2)
Et pour la 5e, je sais pas si c'est obligatoire de mettre * chaleur massique qui est le symbole d'unité c.
Non seulement il faut le mettre pour q5 mais il faut le mettre aussi pour les autres qui en ont besoin.
q1 = K.( f -
f -  1)
1)
q2 = m1.c.( f -
f -  1)
1)
q3 = m2.c2.(0 -  2)
2)
q4 = m2.Lf
q5 = m2.c.( f - 0)
f - 0)
As-tu des questions ? Examine-les bien une à une pour vérifier que tu comprends. Si tu comprends tout alors cette question est résolue pour toi car tous les problèmes de calorimétrie utilisent des relations comme celles-ci.

J'ai compris les quatres premières en ayant analysé les formules et les phrases mais la cinquième, je n'ai pas très bien compris.
Et aussi pour  f= température finale, mais comment la calcule-t-on ?
f= température finale, mais comment la calcule-t-on ?
Ah oui c'est bon j'ai compris, donc la vraie formule reste la vraie formule.
Q = m.c.( 2-
2- 1) est-ce bien ça ?
1) est-ce bien ça ?
C'est tout à fait cela.
Tu as vu que si on connaît le produit m.c alors on utilise sa valeur à la place ; c'est ce qu'on a fait pour le calorimètre et ses accessoires puiqu'on nous donne la capacité calorifique qui est le produit m.c pour le calorimètre
Tu as vu aussi qu'il y a le cas particulier des changements d'état ; ici, c'est une fusion ; elle se produit à température constante, donc la quantité de chaleur s'obtient en multipliant la masse par la chaleur latente de fusion
Pour ma part je retiendrai ta citation :
donc la vraie formule reste la vraie formule

 merci, mais ya juste un tout petit problème, là je dois calculer et comment trouver
merci, mais ya juste un tout petit problème, là je dois calculer et comment trouver  f ou je l'ai déjà c'est -18 °C ?
f ou je l'ai déjà c'est -18 °C ?
Ce n'est pas difficile : il faut écrire que toutes les quantités de chaleur nécessaires pour réchauffer le glaçon, le fondre et encore chauffer l'eau provenant du glaçon sont les quantités de chaleur perdues par le calorimètre et l'eau qu'il contenait au début.
Ou encore que la somme des gains et des pertes de chaleur est nulle (c'est pour cela qu'un calorimètre est bien isolé thermiquement).
Donc q1 + q2 + q3 + q4 + q5 = 0
Il n'y a qu'une seule inconnue :  f
f

lool je n'ai pas compris désolé là en fait c est bon pour l exercice ou il reste à calculer je n ai pas compris

-18 °C ce n'est pas  f c'est
f c'est  2 la température du glaçon quand il sort du congélateur.
2 la température du glaçon quand il sort du congélateur.
Si tu dois calculer  f (tu as écrit avoir trouvé 22,18 °C) il faut le faire comme je l'ai écrit à 15 h 36
f (tu as écrit avoir trouvé 22,18 °C) il faut le faire comme je l'ai écrit à 15 h 36

Pour toi c'est facile je comprend, mais moi c est mon premier cours et je veux bien comprendre car on a un contrôle lundi déjà, désolé si je comprend pas très bien et vite. Si j'ai bien compris j'ai juste à mettre q1+q2+q3+q4+q5=0 et l exercice est fini ?
Exprimer Q1, Q2 et Q3 pour la prochaine fois, c'est tout ce qu'elle a dit la prof.
Eclaires moi merci.
Mais je cherche à t'aider et je ne te fais aucun reproche. Tu comprends quand même que je ne peux pas t'aider si je ne comprends pas la question 
Je ne sais pas ce que sont Q1, Q2 et Q3
Peut-être que
Q1 = q1
Q2 = q2
Q3 = q3 + q4 + q5
Mais je ne peux pas en être sûr... je n'étais pas au cours !
Mais il est certain que Q1 + Q1 + Q3 = 0
et que ceci permet de calculer  f
f

Ah et ben on a fait un petit tableau, tiens :
Alors,
- m1 d'eau liquide  1 = 25 °C.
1 = 25 °C.
|
| Q2
|
m1 d'eau liquide
- m2 de glace  2 = -18 °C.
2 = -18 °C.
|
| Q3 m2 de glace à 0 °C
|
| Q3 d'eau à 0 °C
|
Etat d'equil.  f m2 d'eau liquide
f m2 d'eau liquide
- calorimètre + accessoire  1 = 25 °C.
1 = 25 °C.
|
| Q1
calorimètre + accessoire
Voilà, en sachant que | vers le bas est une flèche et c'est fait en sorte de tableau en commençant de la gauche vers la droie ce que j'ai écrit.
Eh bien voilà ! Je ne pouvais pas le deviner !
Donc ton Q1 est bien q1
ton Q2 est bien q2
et ton Q3 est bien q3 + q4 + q5
Et pour trouver  f il faut bien écrire que
f il faut bien écrire que
Q1 + Q2 + Q3 = 0
Tu as tout ce qu'il te faut.

Mais je comprend pas cmoment calculer, aides moi à commencer stp, q1+q2+q3 mais dans toutes ces formules il ya  f donc on peut pas additionner les trois vu que
f donc on peut pas additionner les trois vu que  f=x
f=x
AIDES MOI A DEBUTER LE CALCUL MERCI
K.( f -
f -  1) + m1.c.(
1) + m1.c.( f -
f -  1) + m2.c2.(0 -
1) + m2.c2.(0 -  2) + m2.Lf + m2.c.(
2) + m2.Lf + m2.c.( f - 0) = 0
f - 0) = 0
Tu remplaces par les différentes valeurs numériques et il te reste une simple équation dont l'inconnue est  f
f

100.( f-25)+200.4,19(
f-25)+200.4,19( f-25)+20.4,19(0-(-18))+20.3,3.105+20.4,19.(
f-25)+20.4,19(0-(-18))+20.3,3.105+20.4,19.( f-0)=0
f-0)=0
Regardes moi si c'est bon mais je pense que m.10-3 non ? après 200 et 20 ?
100 ( f - 25) + 0,200 . 4,19.103 (
f - 25) + 0,200 . 4,19.103 ( f - 25) + 0,020 . 2,1.103 (0 - (-18)) + 0,020 . 3,3.105 + 0,020 . 4,19.103 (
f - 25) + 0,020 . 2,1.103 (0 - (-18)) + 0,020 . 3,3.105 + 0,020 . 4,19.103 ( f - 0 ) = 0
f - 0 ) = 0
Exprime toutes les masses en kg et toutes les énergies en joules, sinon tu prends de grands risques !

tu m'as pas beaucoup aidé enfin j ai une tête dure désolé, mais je n ai rien compris je peréfère laisser tomber, je sais pas quelle formule retenir ni comment faire pour trouver  f mais si tu me donnes la réponse peut etre que je réfléchirai pour la prochaine fois où il yaurait un exercice comme celui-ci.
f mais si tu me donnes la réponse peut etre que je réfléchirai pour la prochaine fois où il yaurait un exercice comme celui-ci.
lool mais non je comprend pas tu expliques en scientifique monsieur le ingenieur  et quand je calcule je trouve des millions et ça fait trois heures j ai rien capter
et quand je calcule je trouve des millions et ça fait trois heures j ai rien capter
desole voulais pas dire ça mais continues de lire la suite, c est que je n arrive à rien, mais tu peux me comprendre c est le premier cours et elle a dit d essayer de faire cet exercice donc moi je veux bien le faire et comme je comprend bien, si tu peux finir ton aide ça serait cool
Bonsoir à toutes et à tous,
J'ai un exercice concernant la calorimétrie et qui me pose problème car la prof nous a demandé d'exprimer Q1, Q2 et Q3.
L'exercice est le suivant :
Dans un ensemble calorimètre et accessoire de capacité calorifique C = 100J.K-1.
On introduit une masse m = 200 g d'eau de chaleur massique c = 4,19.103J.kg-1.K-1, la température est alors  1 = 25 °C.
1 = 25 °C.
On ajoute un glaçon de m2 = 20 g sorti du congélateur à la température  2 = -18 °C.
2 = -18 °C.
La chaleur massique m de la glace d'eau c2 2,1.103J.kg-1.K-1 et enfin la chaleur de la fusion Lf = 3,3.105J.kg-1.
Veuillez m'éclairer à propos de la question car c'est le premier cours qu'on fait avec elle et on a qu'une formule et c'est Q = m.c(tf-t1) et moi j'ai calculé la température finale avec la formule Q = m.c+C(tf-t1), ai-je bon ?
*** message déplacé ***
Bonjour,
Un grand principe du forum : avant de poster, faire une recherche pour vérifier que le sujet n'a pas déjà été traité !
Regarde : 
![]() Calorimétrie
Calorimétrie
Contrairement à ce que pensait la personne qui a posté, il est fini !
Pour apprendre à te servir du moteur de recherche : 
![]() [lien]
[lien]
Pour faire ta recherche : 
![]()
Clique sur les maisons, ce sont des liens !

*** message déplacé ***
Merci, Coll, je ne pensais pas qu'il pourrait y avoir des mêmes exercices. Je trouve 15.7 pour  f en ayant fait q1+q2+q3+q4+q5=0 ? Ai-je bon ?
f en ayant fait q1+q2+q3+q4+q5=0 ? Ai-je bon ?
*** message déplacé ***