Inscription / Connexion Nouveau Sujet
Barycentres, polarité , molécule
Bonjour, bonsoir, j'ai eu une évaluation de physique-chimie hier, et un exercice me perturbe, sur une question de polarité de molécules il me semble que j'ai réussi l'exercice mais j'ai un léger doute :
Molécule : : Propanamide
Représentation :
(Voir en bas)
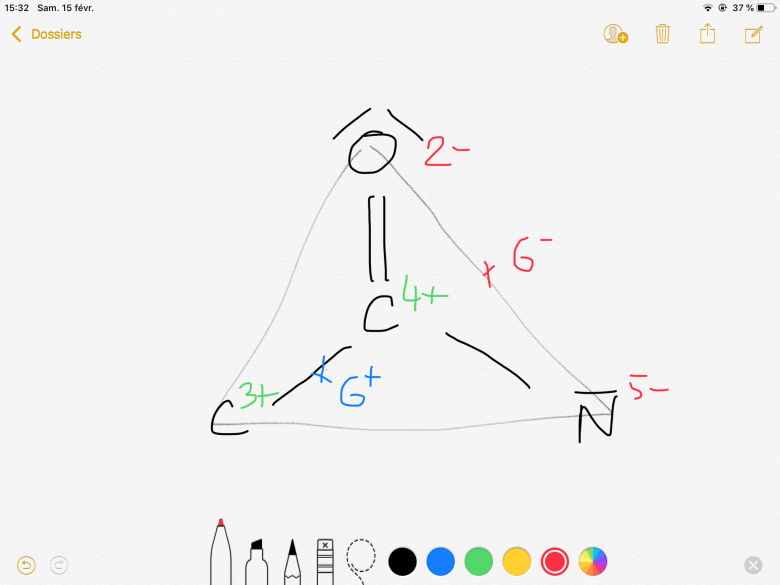
Et la question était que le Carbone relié à l'Oxygène et à l'azote est donc dans un triangle équilatéral (car on avait étudié les représentations), puis on devait faire les barycentres et conclure sur la molécule si elle est polaire ou pas.
(Au passage il existe bien des liaisons polaires dans cette molécule).
Est-ce que mes barycentres sont bien positionnés ?
J'ai donc conclu que la molécule était polaire.
Dernière question, il demendait si la molécule était soluble dans l'eau, j'ai mis non mais apparemment j'ai vérifié c'est oui, j'aimerai donc savoir pourquoi. Merci
Bonjour,
Je ne parlais pas de la structure, mais des + et des -.
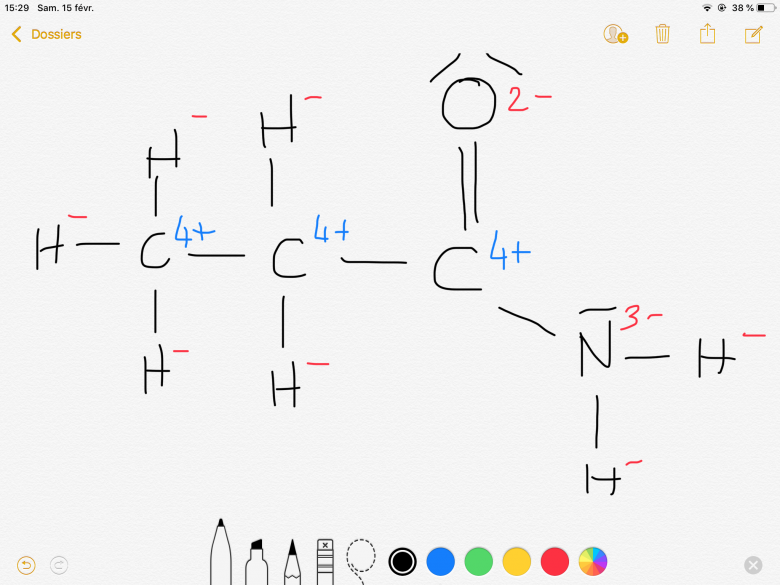
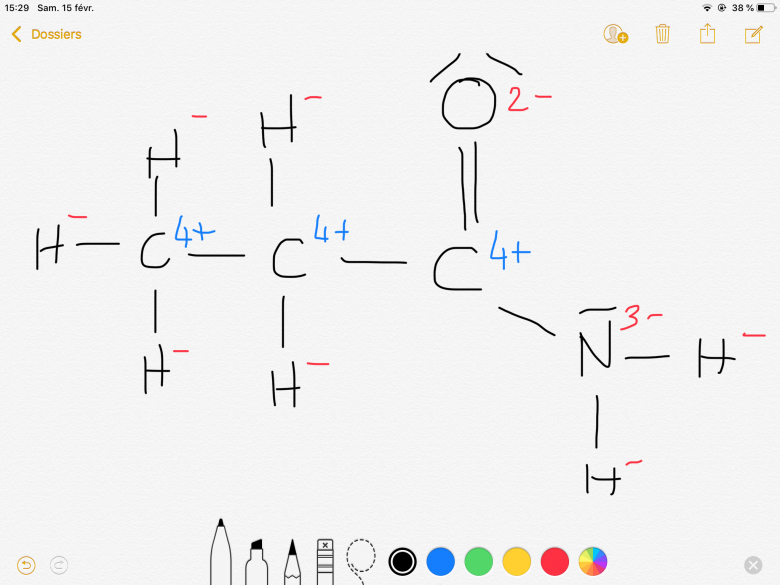
Pour le CH3 extrême à gauche de la première figure, où avez-vous vu (d'où ma demande de référence) un C chargé 4 fois + et des H chargé une fois - ?
Bonjour,
Dit autrement, le but est que vous compreniez où est votre erreur, mais pour cela, on doit d'abord comprendre celle-ci et je ne vois pas d'où sorte les + et les -.
Une possibilité, pas forcément la bonne, est que vous confondiez avec autre chose, une référence permettrait alors de comprendre et d'expliquer la différence entre les deux schémas.
Les charges au niveau des ions permettent de savoir quelles vont être les charges au niveau du triangle, (dans cette question il disait qu'on considerait que la liaison oxygène je sais plus trop quoi était comme la liaison...)
Pour établir la polarité d'une molécule on détermine ses centres de gravite G- et G+ puis si ils ne sont pas confondus et qu'il existe au moins 1 liaisons polaires , la molécule est polaire
(C'est ce que l'on a appris)
Bonjour,
"Pour établir la polarité d'une molécule on détermine ses centres de gravite G- et G+ puis si ils ne sont pas confondus et qu'il existe au moins 1 liaisons polaires , la molécule est polaire"
On est bien d'accord.
Mais pourquoi une charge 1- est attribué à H ?
Pourquoi la charge 4+ sur les carbones ?
Pourquoi la charge 3- sur l'azote ?
C'est en fonction des ions,
Il faut s'arranger pour avoir une molécule neutre électriquement donc le seule moyen est de mettre des - aux hydrogènes, ainsi le carbones pour se stabiliser va perdre 4 electrons en temps normale l'oxygène est 2- il a tendance à prendre des electrons l'azote de même 3-, c'est en fonction de l'electronegativité si je dis pas de bêtises.
Si on prend H+ autour sa marche pas comparée à H2O où la on prend H+.
En gros la molécule est polaire ou pas ?
Sans passer par ce que j'ai fais en temps normal elle est polaire ?
Je commence à mieux comprendre.
Pour la liaison CH, elle n'est quasi pas polarisé, donc les H sont neutres et le carbone associé n'a pas de charge +.
L'oxygène étant plus électronégatif que le carbone, il va y avoir une charge  - sur l'oxygène en provenance de C qui aura donc une charge
- sur l'oxygène en provenance de C qui aura donc une charge  +. Idem entre C et N avec un
+. Idem entre C et N avec un  '- sur l'azote et un
'- sur l'azote et un  '+ sur C ce qui fera (
'+ sur C ce qui fera ( +
+ ')+ sur le carbone. Et pour finir
')+ sur le carbone. Et pour finir  "+ sur les H lié à N, N qui aura donc une charge (
"+ sur les H lié à N, N qui aura donc une charge ( '+2
'+2 ")-
")-
Ducoup mon histoire de charges sur les atomes dans le schéma c'est bon ?
Et la molécule est elle soluble dans l'eau si elle est polaire ou inversement ?
Bonjour
" Du coup mon histoire de charges sur les atomes dans le schéma c'est bon ? "
Non, le H- surtout est très problématique. Pour le reste (CO, CN), les signes sont corrects, mais les valeurs énormes !
"Et la molécule est elle soluble dans l'eau si elle est polaire ?"
Oui
Ducoup pourquoi le H- pose problème ?
Et donc même dans le triangle c'est pas correct. ?
Merci pour ton aide en tout cas