Inscription / Connexion Nouveau Sujet
Avancement et concentration
Bonsoir, j'espère que toutes les personnes lisant ce message vont bien. J'ai un dm en physique-chimie et il y'a des choses que je ne comprends pas. C'est pas trop ma matière forte si vous voyez ce que je veux dire 😅. Enfin bon voici l'énoncé, (j'ai trouvé cette exercice sur ce site avec quelqu'un qui a corrigé mais je n'ai pas tout compris, si vous pouvez m'expliquer j'en serai ravi).
Toutes les réactions ne progressent pas à la même vitesse. On parle de réactions lentes dans le cas de la réaction de formation de la rouille par exemple. Voici un autre exemple de réaction lente : on mélange V1=10 mL d'une solution contenant des ions peroxodisulfates S[2]O[2-/8] avec V2 =20mL d'une solution contentant des ions iodure I-. L'équation bilan correspondant à cette réaction est la suivante :
S2O82- + 2I- => 2SO42- + I2
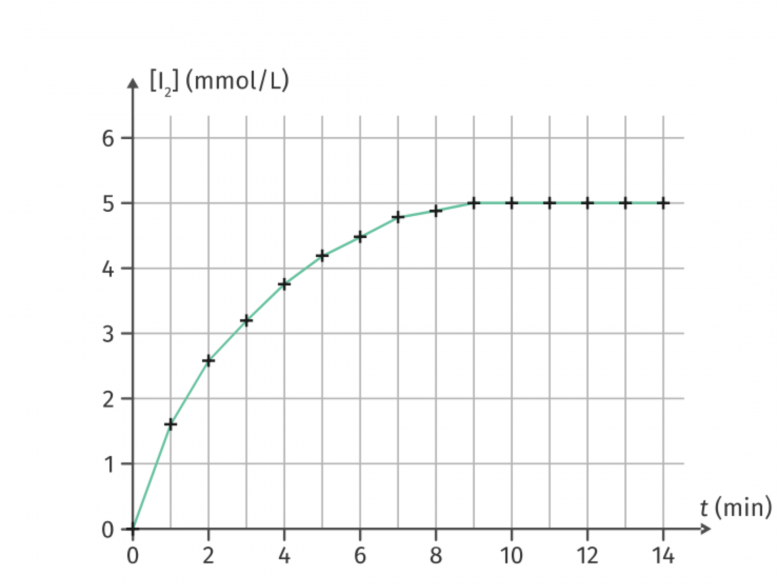
La courbe ci dessous traduit l'évolution de la concentration en diiode (I2) au cours du temps
Questions :
1. Dresser le tableau d'avancement en notant n0 ( S2O82-) et n0 ( I-) les quantités initiales.
2. Déterminer la relation entre [I2] dans le mélange et l'avancement x.
3. En déduire la valeur de l'avancement maximal xmax en utilisant la courbe.
4. Dans le cas où l'ion perixidisulfate S2O82- serait le réactif limitant, quelle devrait être la concentration de la solution de départ contenant ces ions ?
5. Même question avec l'ion d'iodure I-
Pour la 1ère question et la 2nd c'est bon j'ai pu la faire.
C'est à partir de la 3ème que je suis plus sure :
3) xmax= C*V
xmax =5,0*10^-3*30
xmax=0,15
4) Si S2O82- est limitant alors :
n0-0,15=0
n0=0,15 mol
Si I- est limitant alors ´
n0-(2*0,15)=0
n0= 0,30
Pouvez-vous me donner votre avis ? Merci beaucoup d'avance
Bonjour,
Si tu n'as pas reçu de réponse, c'est probablement parce que tu ne détailles pas suffisamment ton raisonnement pour qu'il puisse être facilement vérifié.
Pourrais-tu donc nous fournir tes réponses aux questions 1 et 2, puis détailler davantage tes réponses aux questions suivantes (en n'oubliant pas qu'un avancement de la réaction s'exprime aussi en mol).

Oh d'accord pas de souci alors pour la 1 ère question
Équation de la réaction | S2082- + 2I- => 2S2042- + I2
————————————. |———-—|——-—|——————|————
État initiale. |. n0. |. n0. |. 0. |. 0
————————————————————————————————
État intermédiaire. | n0 - x. |. n0-2x |. x. |. x
————————————————————————————————
État final. |. n0- xmax | n0-2xmax |2xmax | xmax
Et la 2nd :
En s'appuyant sur le tableau d'avancement de la réaction réalisé, la quantité de matière de I2 est égale à la quantité de matière x . Donc n=x=C*V
1. Attention à respecter l'énoncé dans les notations utilisées dans le tableau :
en notant n0 ( S2O82-) et n0 ( I-) les quantités initiales
2. Idem ici, explique ce que tu fais :
- soit V = V1 + V2 le volume total du mélange réactionnel
- à l'état final, la quantité de matière en diiode formée est n(I2) = x si x est l'avancement de la réaction
- donc par définition de la concentration en quantité de matière [I2] = n(I2)/V = x/V
3. Idem ici, bien expliquer ce que tu fais :
- à l'état final, la concentration en diiode formé est [I2] = 5,0 mmol/L = 5,0.10-3 mol/L ;
- or on sait que [I2] = xmax/V <=> xmax = [I2] x V = 5,0.10-3 x (10 + 20).10-3 = ... mol
4. Explique ce que tu fais, à l'image de ma rédaction.
5. Idem.

Merci beaucoup. Mais honnêtement il y a quelque chose que je n'ai pas compris pourquoi dans la question 2 dans ta rédaction tu as calcule enfin écris le calcul plutôt de la concentration en quantité de matière de I2. Enfaite je n'ai pas compris ça :
« si x est l'avancement de la réaction
- donc par définition de la concentration en quantité de matière [I2] = n(I2)/V = x/V »
La concentration en quantité de matière de note n est donc la formule devrait être C*V . Et du coup j'ai pas compris aussi ça :
« or on sait que [I2] = xmax/V <=> xmax = [I2] x V = 5,0.10-3 x (10 + 20).10-3 = ... mol »


