Inscription / Connexion Nouveau Sujet
avancement
Bonjour, j'aurais besoin d'aide pour cet exercice :
L'oxyde d'aluminium Al2O3(s), peut être obtenu en faisant réagir à chaud du métal d'aluminium Al(s) avec du dioxygène O2(g). Au cours d'une réaction, une masse m d'aluminium a totalement réagi dans un excès de dioxygène. Il se forme 0,25 mol d'oxyde d'aluminium.
a) Ecrire l'équation de la réaction
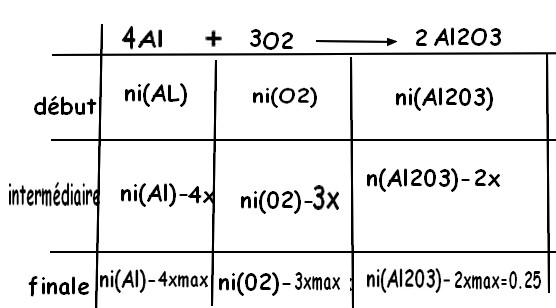
b) Construire le tableau d'avancement
c) Déterminer xmax
d) Calculer m d'aluminium consommée.
J'ai fait :
a) Al+O2=AL2O3
b) je ne suis pas sure
c)xmax=0.25
d) m=nxM
m=0.25x(27x2+3x16)=14.25g
merci de me corriger
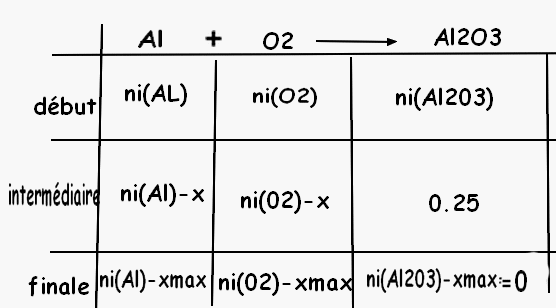
la première chose à faire est d'équilibrer l'équation.
Il faudra donc reprendre ton tableau
d'autre part,la qté 0,25 doit se trouver sur la ligne finale et non intermédiaire
[quote][je n'ai pas encore appris à équilibrer une équation /quote]
ça s'apprend en 3ème
il faut avoir le même nomre d'atomes de chaque sorte de chaque côté...
telle que tu as écriit l'équation
à gauche : 1 "Al" 2"O"
à droite : 2"Al" 3"O"
ça ne va donc pas
non ,ce n'est pas équilibré en "O" . (6 à gauche ,3 à droite)
Il faut 3/2 de O2
pour éviter le coefficient fractionnaire on multiplie par 2 les coefficients
on a donc
4Al + 3 O2 =2 AL2O3
c'est bien pour les réactifs ,mais Al2O3 est un produit
initialement on a n(Al2O3)=0
intermédiaire +2x
final +2xmax =0,25 mol
cela permet de calculer x max
on soustrait côté réactifs puisqu'ils disparaissent d'où les -4x et - 3x
côté produit ,il se forme de la matière d'où le + 2x.
Dans beaucoup de problèmes on indique (ou on peut calculer) les qtés de matière initiales des réactifs,donc on cherche quelle est la plus petite valeur de x qui annule la qté initiale des réactifs
dans ce problème on ne connait pas la qté initiale de O2 ni de Al .
On sait par contre que Al est limitant.
D'autre part on sait qu'il se forme 0,25 mol de Al2O3
A l'état final ,il se sera formé 2x max de Al2O3
donc 2xmax= 0,25 soit xmax= 0,125 mol
puisque Al est limitant ,n(Al)i-4xmax=0
n(Al)i=4xmax=4*0,125 =0,5 mol

 AL203 fonctionne non ?
AL203 fonctionne non ?