Inscription / Connexion Nouveau Sujet
Alcootest et spectrophotométrie du dichromate de potassium
Bonjour, j'ai un exercice de physique dont l'énoncé est le suivant:
"Un automobiliste décide de recueillir la totalité des cristaux de dichromate de potassium K2Cr2O7 (s) ( jaune orange) présents dans plusieurs tubes en plastique d'alcootest neufs qu'il dissout dans une fiole jaugée de
100,0 mL à l'aide d'eau distillée. Après agitation et dissolution totale des cristaux, il obtient une solution notée S jaune orangée de dichromate de potassium 2K + (aq) + Cr2O7 2 - (aq) de concentration CS inconnue.
Pour doser par spectrophotométrie, cette solution S réalisée de dichromate de potassium 2K + (aq) + Cr2O7 2 - (aq) , il prépare quatre solutions de concentrations Cf différentes à partir d'une solution initiale de dichromate de potassium 2K + (aq) + Cr2O7 2 - (aq) de concentration Ci = 5,0 mmol . L - 1.
Il réalise la mesure de l'absorbance A de chaque solution avec un spectrophotomètre UV-visible réglé à la longueur d'onde  = 450 nm, les résultats sont les suivants :
= 450 nm, les résultats sont les suivants :
| Cf ( mmol . L - 1 ) | 1,0 | 2,0 | 3,0 | 4,0 | 5,0 |
| A | 0,30 | 0,60 | 0,90 | 1,20 | 1,50 |
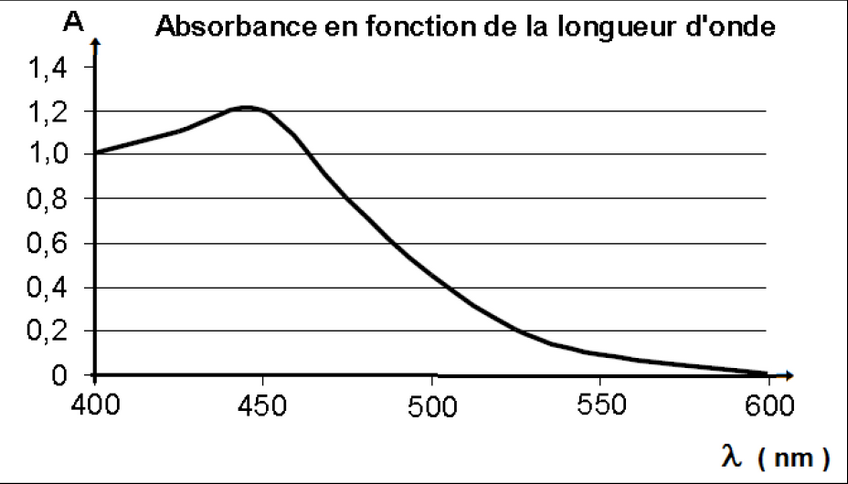
Le spectre d'absorption d'une solution de dichromate de potassium (voir attache)
1.1.1. Quel volume Vp faut-il prélever de la solution initiale de dichromate de potassium 2K + (aq) + Cr2O7 2 - (aq) de concentration Ci = 5,0 mmol.L - 1 pour préparer un volume Vf = 50,0 mL d'une solution de concentration Cf = 2,0 mmol.L - 1 ?
1.1.2. S'agit-il d'une dissolution ou d'une dilution ?
1.1.3. Représenter l'opération réalisée par une suite de schémas légendés en précisant le nom et le volume de toutes verreries utilisées pour préparer cette solution, parmi la liste suivante :
. béchers 20 mL, 50 mL, 100 mL ;
. pipettes jaugées 5,0 mL, 10,0 mL, 20,0 mL ;
. éprouvettes graduées 5 mL, 10 mL, 20 mL ;
. fioles jaugées 20,0 mL, 50,0 mL, 100,0 mL.
. pissette d'eau distillée
. pipeteur ou propipette (poire aspirante)
1.2. Justifier la valeur de la longueur d'onde choisie pour mesurer l'absorbance A de chaque solution avec un spectrophotomètre UV-visible.
1.3. 1. Tracer la courbe d'étalonnage A = f ( C ) .
1.3. 2. Justifier, à partir de la courbe d'étalonnage, que les grandeurs portées sur le graphe sont liées par une relation de la forme A = k . C. La loi de Beer-Lambert est-elle vérifiée ?
1.3. 3. Calculer le coefficient directeur k.
2.Dans les mêmes conditions de mesures et sans modifier les réglages du spectrophotomètre, on mesure l'absorbance de la solution S : AS = 1,02.
2.1. Déterminer graphiquement la concentration molaire de la solution S en dichromate de potassium apportée en faisant clairement apparaître la méthode utilisée sur le graphe.
2.2 En déduire la masse de dichromate de potassium apportée dans la fiole jaugée de 100,0 mL
2.3. Combien de tubes l'automobiliste a-t-il démonté sachant qu'un tube contient au total une masse m= 5,0 mg de dichromate de potassium.
Données : La masse molaire moléculaire du dichromate de potassium M= 294 g . mol -1"
Je voulais que vous me donniez votre avis sur mon travail
1.1.1) Ci=5,0 mmol.L-1 Cf=2,0 mmol.L-1
Vf=50,0 mL
Ci.Vi=Cf.Vf
 Vi=(Cf.Vf)/Ci
Vi=(Cf.Vf)/Ci
Vi=((2,0.10^-3)*(5,0.10^-2))/(5,0*10^-3)=2,0.10^-2L
1.1.2) Il s'agit d'une dilution
1.1.3) Je n'ai pas encore fini

1.2) On a réglé le spectrophotomètre UV-visible à
 =450nm car il faut être à une longueur d'onde proche du maximum d'absorption ici à 450 nm.
=450nm car il faut être à une longueur d'onde proche du maximum d'absorption ici à 450 nm.
1.3.1) Voir graphique
1.3.2) On a une courbe qui passe par l'origine du repère donc d'équation y=a.x, donx A=k.C. La loi de Beer-Lambert est vérifiée.
1.3.3) A=k.C
 k=A/C
k=A/C
k=0,30/1,0=0,30
2.1) D'après le graphique on a Cs= 3,4 mmol.L-1
2.2) C=m/(M.V)
 m=C.M.V
m=C.M.V
m=(3,4.10^-3)*294*(1,0.10^-1)
=10g
2.3) 10/(5,0.10^-3)= 2000
L'automobiliste a démonté 2000 tubes.
Pouvez-vous me donner votre avis s'il vous plaît? Merci
Bonsoir, voilà ce que j'ai fait pour le 1.1.3., qu'en pensez-vous?
Sur ce lien (https://www.ilephysique.net/chimie_terminale-diluer-solution.php), il y a une étape intermédiaire:
"(a) Remplir la fiole jaugée aux trois quarts avec de l'eau distillée.
(b) Après l'avoir bouchée, l'agiter pour homogénéiser la solution."
Elle se déroule avant de remplir la fiole jusqu'au trait de jauge. Cette étape est-elle nécessaire? Devrais-je la rajouter selon vous? Merci


