Inscription / Connexion Nouveau Sujet
alcane
Bonsoir, je ne comprends pas la première question de cet exercice, du coup je ne peux pas faire la suite, pourriez vous m'aider? Le voilà:
Au cours de la combustion complète d'un alcane dans le volume nécessaire de dioxygène, on récupère m1=13,2g de dioxyde de carbone et m2=7,2 g d'eau.
a)Ecrire et équilibrer l'équation de combustion complète d'un alcane non cyclique
b)Calculer les quantités de matières de dioxyde de carbone et d'eau obtenues
c)Dresser un tableau d'avancement, en notant n0 la quantité de matière initiale d'alcane
d)En utilisant toutes les informations, déterminer l'alcane et donner son nom
__________________________________
a)? + O2(g) CO2(g)+ H2O(l) sauf qu'on ne connait pas l'alcane "?" alors comment équilibrer?
CO2(g)+ H2O(l) sauf qu'on ne connait pas l'alcane "?" alors comment équilibrer?
merci d'avance 
Bonjour
a) un alcane non cyclique s'écrit CnHm.
L'équation de la réaction de combustion s'écrit donc (je t'aide un peu): CnHm + bO2 = nCO2 + dH2O
a toi de trouver b et d
je choisis le notation CnHm même si je pense que n pourrait être confondu avec une quantité de matière mais bon, d'ailleurs, pourquoi mets tu n à deux endroits?
Je dirais : CnHm + 1O2 = nCO2 + 2H2O
donc b=1 et d=2
et m et les n? on peut pas deviner..
En fait comme l'alcane est non cyclique il est de la forme CnH2n+2
et si on écrit les coefficients stoechiométriques en fonction de n ça donne:
CnH2n+2 + 4nO2 = nCO2 + 2nH2O
conformez vous?
ha non, au niveau des O ça ne va pas, mais j'arrive à un truc fou:
CnH2n+2 + ((3n+1)/2)O2 = nCO2 + (n+1)H2O

Bonjour,
C'est ça.
Tu trouveras peut-être des informations par ici : ![]() Chimie organique.
Chimie organique.
Le problème c'est que ne connaissant pas n, alors comment résoudre la question 2?
Surtout que quelles sont les expressions des quantités de matières du CO2 et de l'H20 obtenues?
n*n(O2) et (n+1)*n(H2O)?
les masses molaires sont M(O2)=44,0 g/mol et M(H20)=18,0g/mol...
C'est normal que tu connaisses pas n, c'est l'inconnue ! Tu dois le déterminer.
Tu connais les masses obtenues des produits, tu peux donc calculer les quantités de matières obtenues des produits.
Et en réalisant un tableau d'avancement, tu vois que ces quantités de matière dépendent de n et de l'avancement maximal.
a) Fait.
b) Pas compliqué en appliquant la formule n=m/M.
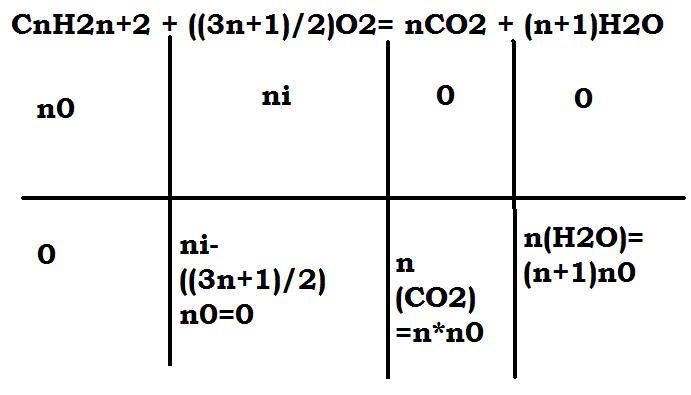
c) Exprime les quantités de matières des produits obtenues à l'étal final en fonction de n et de n0.
d) Fais le rapport n(C02)/n(H20). n0 va se simplifier et tu pourras déterminer la valeur de n puisque toutes les données nécessaires sont connues.
b) n(CO2)=m1/M(CO2) et n(H2O)=m2/M(H2O)
c) n(CO2)=n*n0 et n(H2O)=(n+1)n0
d) n(CO2)/n(H2O)=n/(n+1) d'où n=...
Il doit surement falloir déterminer l'avancement maximal:
soit nCnH2n+2 - x= 0 donc nCnH2n+2 =x
ou
nO2 - ((3n+1)/2)x=0
donc x= nO2*2/(3n+1)
mais ne connaissant pas les deux quantités de matières initiales, on ne peut pas dire quel est le plus petit des x, donc dire quel est l'avancement maximal 
Il doit surement falloir déterminer l'avancement maximal:
Pour la question c oui, pour la question b non.
mais ne connaissant pas les deux quantités de matières initiales, on ne peut pas dire quel est le plus petit des x, donc dire quel est l'avancement maximal
L'alcane est le réactif limitant parce que le dioxygène est en excès :
dans le volume nécessaire de dioxygène
a) .
b) mol et
mol
c) et
d) d'où
. L'alcane recherché est donc le propane de formule brute
.
Sauf erreur...
Donc le fait que ça soit écrit "dans le volume de O2 nécessaire" prouve que c'est n0 l'avancement maximal? c'est pas le plus explicite qu'on puisse faire pour moi
a)Ok
b)Je trouve n(C02)=3,00.10-1 mol obtenues et n(H2O)=4,0.10-1 obtnues.
c)
Donc le fait que ça soit écrit "dans le volume de O2 nécessaire" prouve que c'est n0 l'avancement maximal? c'est pas le plus explicite qu'on puisse faire pour moi
Si on te dit qu'il y a un volume de dioxygène nécessaire, ça veut juste dire qu'il y en aura suffisamment pour consommer tout l'alcane. Donc c'est équivalent à dire que l'alcane est le réactif par défaut alors que le dioxygène est le réactif en excès...
b)Je trouve n(C02)=3,00.10-1 mol obtenues et n(H2O)=4,0.10-1 obtnues.
Oui, cf : mes messages précédents.
c)
Ton tableau d'avancement n'est pas complet : il faut une ligne pour l'état initial (n0, /, 0, 0) et une ligne pour l'état final (0, /, nn0, (n+1)n0).
Pour la colonne du dioxygène, indique seulement "en excès".
ma première ligne est la ligne de l'état initial et la deuxième ligne est la ligne de l'état final, pourquoi ce n'est pas correct?
Je n'ai rien dit alors : je ne l'avais tout simplement pas vu.
Donc ok pour le tableau d'avancement, sauf que personnellement j'indiquerai "en excès" dans la colonne du dioxygène.
Dac. C'est vrai que j'avais oublié de préciser à quoi correspond chaque colonne
d) Je ne comprends pas pourquoi tu fais le quotient des deux quantités de matières trouvées, peux tu m'expliquer?
merci à toi 
d) Je ne comprends pas pourquoi tu fais le quotient des deux quantités de matières trouvées, peux tu m'expliquer?
Tout simplement parce que n0 est inconnue, il faut donc bien s'en débarrasser !
Soit tu exprimes n0 en fonction des données connues dans l'une des deux expressions que tu injectes dans l'autre expression pour en déduire n, soit tu fais le rapport comme je l'ai indiqué.
je ne comprends pas ton calcul à la d) n=n(CO2)*(n+1)/(n(H2O) non?
pourquoi tu écris n= n(CO2)/(n(H2O)-n(CO2))?
Ce ne sont que des maths...
Fais le rapport n(C02)/n(H20), puis fais un produit en croix, ensuite factorise par n puis déduis-en l'expression de n.
Rhooo, le produit en croix et la factorisation ça se voit au collège ça 
d'où
(produit en croix) soit
(développement) puis
(passage à gauche de l'égalité) donc
(factorisation) d'où
(passage à droite de l'égalité) soit, finalement,
(j'ai distribué le signe moins au dénominateur).
Ça ne peut pas être PLUS détaillé !


