Inscription / Connexion Nouveau Sujet
activité 2
Dans un tube à essais, on verse un v=50mL d'argent de solution de nitrate d'argent de concentration molaire en ion argent, C=0.20mol/L.on immerge partiellement un fil cuivre. La masse de la partie immergée est m= 0,52 g.
Le fil de cuivre se recouvre progressivement d,un dépôt gris d,argent métallique et la solution bleuit
L'équation de la réaction qui se produit entre les ions argent et Ie métal cuivre est
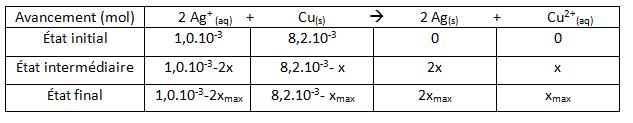
2 Ag+(aq) + Cu(s) donne 2 Ag(s) +Cu2+
calculer les quantités initiales des réactifs; les exprimer en mmol.
Établir le tableau d,avancement de le réaction.
Déterminer le réactif limitant.
je n'y arrive pas. je sais pas comment commencer aidez moi.
je n'ai aps de cours dessus encore.
merci
1*10^-3 mol mais il faut le convertir en mmol je fais comment?
c'est la quantité de matiere du nitrate d'argent j'suis pas sur
c'est bien en mol. 1000 mmol = 1 mol
Donc c'est la quantité de matière initiale en ions argent dans ton équation
ben moi aussi
8,2.10-3-xmax = 0 <=> xmax = 8,2.10-3 mol
1,0.10-3-2xmax = 0 <=> xmax = 5,0.10-4 mol
Donc le réactif limitant c'est plutôt l'ion argent
car c'est l ion argent qui a la plus petite valeur
merci beaucoup et puis bonne soirée j'espere que je t'es pas empechée de manger
merci encore!
tu c l'année dernier j'y arrivais en physique mais cette année me parrait bien compliquer

 !
!