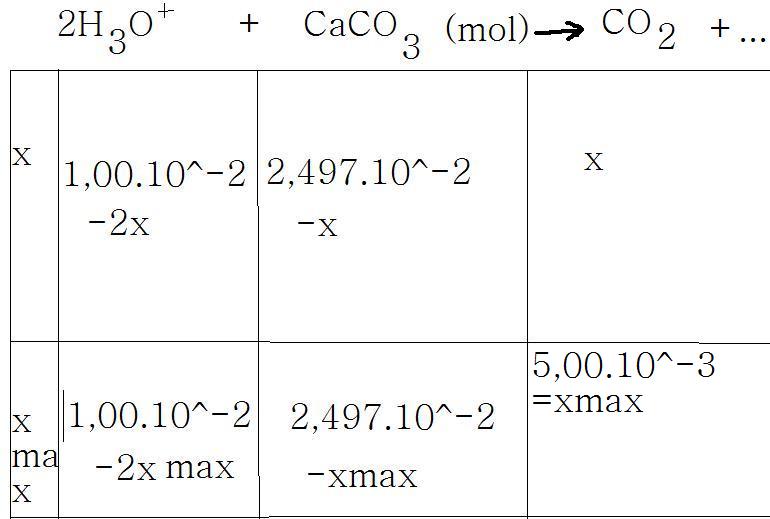Inscription / Connexion Nouveau Sujet
acide chlorydrique
Bonjour, pourriez vous m'aider à comprendre cet exo (de DM)?
Pour éliminer le calcaire qui se dépose sur ses sanitaires, René entend utiliser de l'acide chlorhydrique.
Pour vérifier si ça marche bien, il fait un essai préalable.
Dans un ballon, il verse un volume V=100mL d'acide chlorhydrique (dont le principe actif ici est l'ion oxonium H3O+) de concentration c=0,10mol.L-1, puis ajoute rapidement m=2,5g de carbonate de calcium CaCO3. la transformation libère du dioxyde de carbone gazeux, de l'eau liquide et des ions calcium Ca2+ en solution.
a)Donner la structure électronique de l'élément calcium et justifier qu'il forme facilement l'ion Ca2+.
b)Ecrire et équilibrer l'équation de la réaction qui se produit.
c)Déterminer l'avancement maximal de la réaction.
d)Sachant que le volume molaire des gaz dans les conditions de l'experience est Vm=24,2L.mol-1, déterminer le volume de dioxyde de carbone formé.
pour la a)
le nombre d'électrons d'un atome de calcium est 20 donc la structure électronique de l'elément calcium est (K)2(L)8(M)8(N)2
quelle est la différence entre l'atome et l'élément ici? ma réponse est elle fausse?
b)2H3O+ + CaCO3 CO2+3H2O+Ca2+
CO2+3H2O+Ca2+
c)pour cela il faut la quantité de matière d'acide chlorhydrique et de carbonate de calcium mais comment les trouver?
cependant grande question : les 2,5g ajoutés changent ils le volume V=100mL ou peut on le negliger? sinon comment le prendre en compte, changr le volume?
merci d'avance
Salut !
!
a) ok
b) Tu peux condenser dans les produits pour le dioxyde de carbone et l'eau
c) l'acide est en excès et tu as sa concentration et son volume
a)"justifier qu'il forme facilement l'ion Ca2+" car il a deux électrons sur la dernière couche..?
b)c'est à dire?
c)comment sais tu que c'est lui qui est en excès? quand on demande l'avancement maximal c'est xmax ?
d)on verra après
de plus, les 2,5g ajoutés changent ils le volume V=100mL ou peut on le negliger?
merci à toi
a) oui TB
b) Tu prends le couple (CO2,H2O). Mais c'est très bien comme ça, il n'y a pas réellement besoin de modifier
c) effectivement, n'importe quoi.
Calcule n(acide) = c*V
et n(calcaire) = m/M
a) comment être plus précise sur la formation de cet ion?
b)bon je laisse l'équation comme ça 
c)tu veux dire n(carbonate de calcium) veut dire n(calcaire) ?
dans ce cas
n(acide)=0,10X0,1=1,00.10^-2 mol
et n(calcaire)= 2,5/100,1=2,497.10^-2 mol
et je fais un tableau d'avancement pour trouver xmax soit l'avancement maximal?

c)
1,00.10^-2 -2max = 0
xmax = 1,00.10^-2 / 2
xmax=0,005
ou
xmax = 2,497.10^-2
on prend la plus petite valeur qui est 0,005
donc l'avancement maximal est 0,005
je passe au d si c'est bon 
ha oui erreur d'inattention.
V(CO2)= n(CO2)X Vm = 5,00.10^-3 X 24,2 = 1,21 L
1,21L de CO2 est formé.
c'est cela? 
rebonsoir, j'aurais besoin d'une petite précision :
a)Donner la structure électronique de l'élément calcium et justifier qu'il forme facilement l'ion Ca2+.
on a dit :"l'atome devient un cation pour devenir plus stable.","pour se rapprocher de la structure électronique de l'atome le plus stable" mais quel atome plus stable? Je ne comprends pas vraiment en quoi ça le rend plus stable de perdre 2 électrons..
merci

Re !
!
Dans la classification périodique, tu as la colonne des gaz inertes (également appelés gaz rares ou gaz nobles).
Ce sont des atomes stable, ils ne s'ionisent pas car leur couche électronique externe est saturée et possède 2 ou 8 électrons.
Dc les autres atomes vont essayer d'obtenir cette structure stable (en s'ionisant), c'est ce qu'on appelle la règle du duet et de l'octet.