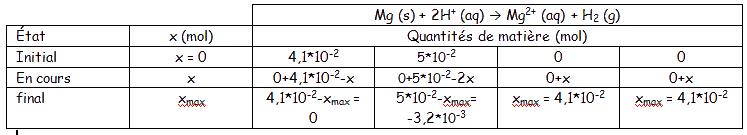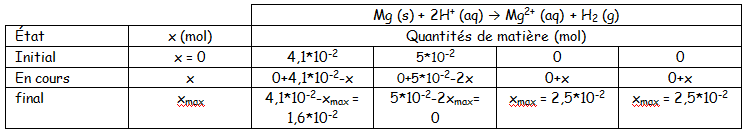Inscription / Connexion Nouveau Sujet
Acide chlorhydrique et magnésium
Bonsoir,
J'ai un exercice dans un DM à faire en physique et je n'y comprend rien. En effet, la prof nous a une fait une présentation de ce nouveau chapitre; c'est pourquoi je demande votre aide.
Voici le sujet :
Le magnésium Solide Mg (s) réagit avec l'acide chlorhydrique (H+(aq)+Cl-(aq)) pour former des ions Mg2+(aq) et du dihydrogène H2(g).
1. Les ions chlorure étant spectateurs, écrire l'équation de la réaction.
2. Dresser le tableau d'évolution dans un cas général.
3. Dans un ballon contenant un volume V = 50 mL d'acide chlorhydrique de concentration c = 1,0 mol.L-1, on verse une masse m = 1,0 g de magnésium.
a. Déterminer la quantité de matière initiale de chacun des réactifs.
b. Déterminer le réactif limitant et la valeur de l'avancement maximal.
C. Quelle sera la composition du système à l'état final ?
d. Quel est le volume de dihydrogène dégagé lors de la transformation ? Dans les conditions de l'expérience, une mole de gaz occupe 24 litres.
Données. Masse molaire atomique du magnésium : 24 g.mol-1
Ce que j'ai fais :
1. Mg (s) = H+ (aq) + Cl- (aq)  Mg2++H2 (g).
Mg2++H2 (g).
2. ?
3. a. n=c*v donc n=1,0*50=50
b. ?
c. ?
d. ?
Bonjour,
1. Puisque les ions chlorures sont spectateurs, ils ne doivent pas apparaître dans l'équation. Ce qui donne: Mg(s) + H+(aq)  Mg2+(aq) + H2(g)
Mg2+(aq) + H2(g)
2. Il faut, je pense, dresser le tableau d'avancement de la réaction, avec quatre lignes (équation chimique, quantité de matière à l'état initial, intermédiaire et final), avec une colonne par réactif et par produit, sans rentrer de valeurs numériques.
3.a) On te demande les quantités de matière du magnésium et de l'hydrogène à l'état initial.
Il faut effectivement utiliser la formule n=c*v pour trouver la quantité d'hydrogène, mais il faut convertir le volume en litre.
Pour la quantité de magnésium, il faut utiliser la formule n=m/M (on nous donne M dans les données). Je te laisse le soin de faire les applications numérique.
b) Le réactif limitant est celui qui a la plus petite quantité de matière. Pour trouver l'avancement, si par exemple (je le prend au hasard) le magnésium est le réactif limitant, alors xmax=nMg(s).
c) En trouvant xmax, tu peux compléter le tableau.
d) V= Vm/n (Vm est le volume molaire: une mole de gaz occupe 24 litres, c'est à dire que Vm = 24 mol/L je crois).
J'espère que ça t'aidera.
Bonjour,
ça pourrait être ça alors ? (je me suis inspiré de ce que vous m'avez dit et le cours du livre) :
1. Puisque les ions chlorures sont spectateurs, ils ne doivent pas apparaître dans l'équation. Ce qui donne: Mg(s) + H+(aq)  Mg2+(aq) + H2(g)
Mg2+(aq) + H2(g)
2. Ci-joint.
3.a) c = 1,0 mol.L-1
v = 50 mL = 5*10-2 L
On a donc la relation n=c*v pour trouver la quantité de matière initiale du dihydrogène.
A.N. n = 1,0*5*10-2 = 5*10-2 mol.
m = 1,0 g
M = 24 g.mol-1
On a donc la relation n=m/M pour trouver la quantité de matière initiale du magnésium.
A.N. n = 1,0/24 = 4,1*10-2 mol
b) Le réactif limitant c'est le réactif qui s'épuise en premier, et qui entraîne l'arrêt de la transformation. Ici, le réactif limitant est donc le dihydrogène. Comme le dihydrogène est le réactif limitant, on résout les équations suivantes pour déterminer xmax :
4,1*10-2-x = 0 soit x = 4,1*10-2
5*10-2-x = 0 soit x = 5*10-2
On a donc xmax = 4,1*10-2 mol.
c) Dernière ligne du tableau.
d)Vm = 24 mol.L-1
n = 0.05 mol
On a donc la relation V = Vm/n pour trouver le volume de dihydrogène dégagé lors de la transformation.
A.N. V = 24/0.05 = 4,8*10-2 L.
Vm = 24 mol.L-1
n = 5*10-2 mol
On a donc la relation V = Vm/n pour trouver le volume de dihydrogène dégagé lors de la transformation.
A.N. V = 24/5*10-2 = 4,8*10-2 L.
Est-ce que c'est juste ?
Merci
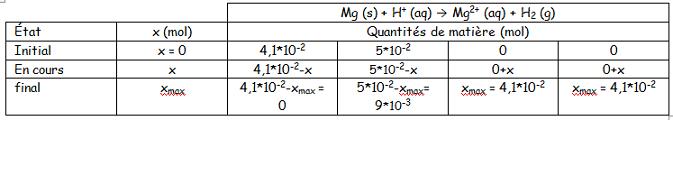
Je ne sais pas comment on modifie un message.
C'était juste pour dire que la question d. c'est le deuxième paragraphe le juste. Le premier j'avais oublié de mettre sous la forme 10 puissance.
il y a une erreur initiale
l'équation n'est pas équilibrée en H
il faut 2 H+ à gauche
Il faut de ce fait revoir le choix du facteur limitant
Ah oui effectivement mais il faut aussi mettre alors un 2 devant le Mg non ?
Ce qui donnerait pour la question 1. Puisque les ions chlorures sont spectateurs, ils ne doivent pas apparaître dans l'équation. Ce qui donne: 2 Mg(s) + 2 H+(aq) Mg2+(aq) + H2(g).
C'est ça ?
Tout change alors n'est-ce pas ?
Merci
Mais non!
1 atome de Mg donne 1 ion Mg2+
2 H+ sont nécessaires pour obtenir 1 H2
Je te recommande de faire des exercices d'équilibrage d'équations chimiques
l'équation est
Mg(s) + 2H+ (aq) =Mg2+ (aq) +H2 (g)
ah ok d'accord, j'ai compris maintenant ! 
Je corrigerais les fautes demain matin si j'ai encore le temps ou demain après-midi et vous pourriez ensuite me dire si c'est juste ?
il faut revoir le tableau d'avancement
en cours de réaction
n(Mg)= no(Mg) -x
n(H+)= no(H+)-2x
n(Mg2+)= x
n(h2)=x
bonjour,
je ne suis pas d'accord pour xmax
Pour que n(Mg)=0 il faut que 0,041-x= 0 soit x=0,041
Pour que n(H+)= 0 il faut que 0,050-2x=0 soit x =0,025
Donc xmax =0,025 mol
Je réecris la question 3. b. :
3. b. Le réactif limitant c'est le réactif qui s'épuise en premier, et qui entraîne l'arrêt de la transformation. Ici, le réactif limitant est donc le dihydrogène. Comme le dihydrogène est le réactif limitant, on résout les équations suivantes pour déterminer xmax :
4,1*10-2-x = 0 soit x = 4,1*10-2
5*10-2-2x = 0 soit x = 2.5*10-2
On a donc xmax = 2.5*10-2 mol.
Donc le tableau d'avancement est cette fois-ci :
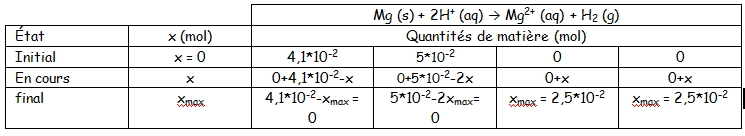
Ok merci 
C'est pour quelle question
reste à calculer v(H2) et la concentration en Mg2+
Pour la question 3. d. ?
C'est pas ça ? :
d.Vm = 24 mol.L-1
n = 5*10-2 mol
On a donc la relation V = Vm/n pour trouver le volume de dihydrogène dégagé lors de la transformation.
A.N. V = 24/5*10-2 = 4,8*10-2 L.
Comment fait-on pour calculer V(H2) et C(Mg2+) ?
3c) quelle est la constitution du milieu à l'état final
il reste 0,016 mol de Mg
il s'est formé 0,025 mol de Mg2+ (éventuellemnt on peut calculer la concentration en Mg2+) et 0,025 mol de H2
3)d calcul de V(H2)
V= n*VM= 0,025*24=0,6L
la formule que tu as utilisée est fausse .
En cas de trou de mémoire ,il faut vérifier la cohérence des unités
n est en mol
VM est un volume par mol donc L/mol
V est un volume en L
si on met les unités à la place des symboles n,VM, V,on doit retrouver la même chose à droite et à gauche
la formule V=n*VM est valable car
L=mol* L/mol
en simplifiant par mol on trouve L=L
par contre si tu utilises V= VM/n = VM*1/n ,on a
L= L/mol *1/mol=L/mol2 ce qui est faux
ce type de vérification est très utile quand on a un doute sur une formule
un autre exemple :relation entre C n V
Est-ce que c'est n=C*V ?
vérification
V en L
n en mol
C en mol/L
on aura mol= mol/L *L
en simplifiant par L on obtient mol=mol
n=C*V est la bonne formule
Ok merci beaucoup.
C'est sympa l'astuce pour vérifier une formule ! ça va beaucoup m'aider 
Voici un récapitulatif avec toute les corrections :
1. Puisque les ions chlorures sont spectateurs, ils ne doivent pas apparaître dans l'équation.
Ce qui donne: Mg(s) + 2H+(aq) Mg2+(aq) + H2(g)
Mg2+(aq) + H2(g)
2. (Le tableau d'évolution)
3. a. c = 1,0 mol.L-1
v = 50 mL = 5*10-2 L
On a donc la relation n=c*v pour trouver la quantité de matière initiale du dihydrogène.
A.N. : n = 1,0*5*10-2 = 5*10-2 mol.
m = 1,0 g
M = 24 g.mol-1
On a donc la relation n=m/M pour trouver la quantité de matière initiale du magnésium.
A.N. n = 1,0/24 = 4,1*10-2 mol
b. Le réactif limitant c'est le réactif qui s'épuise en premier, et qui entraîne l'arrêt de la transformation. Ici, le réactif limitant est donc le magnésium. Comme le magnésium est le réactif limitant, on résout les équations suivantes pour déterminer xmax :
4,1*10-2-x = 0 soit x = 4,1*10-2
5*10-2-2x = 0 soit x = 2,5*10-2
On a donc xmax = 2,5*10-2 mol.
c) Comme c'est indiqué dans la dernière ligne du tableau d'évolution, à l'état final du système, il reste 1,6*10-2 mol de Mg, 2H+ a disparu et il s'est formé 2,5*10-2 mol de Mg2+ et 2,5*10-2 mol de H2
d) Vm = 24 mol.L-1
n = 2,5*10-2 mol
On a donc la relation V = n*Vm pour trouver le volume de dihydrogène dégagé lors de la transformation.
A.N. V = 2,5*10-2 *24 = 6*10-1 L.
Y-a-t-il une erreur quelque part ?