Inscription / Connexion Nouveau Sujet
Acide base
Bonjour, j'aurais besoin d'aide pour un exercice de chimie..
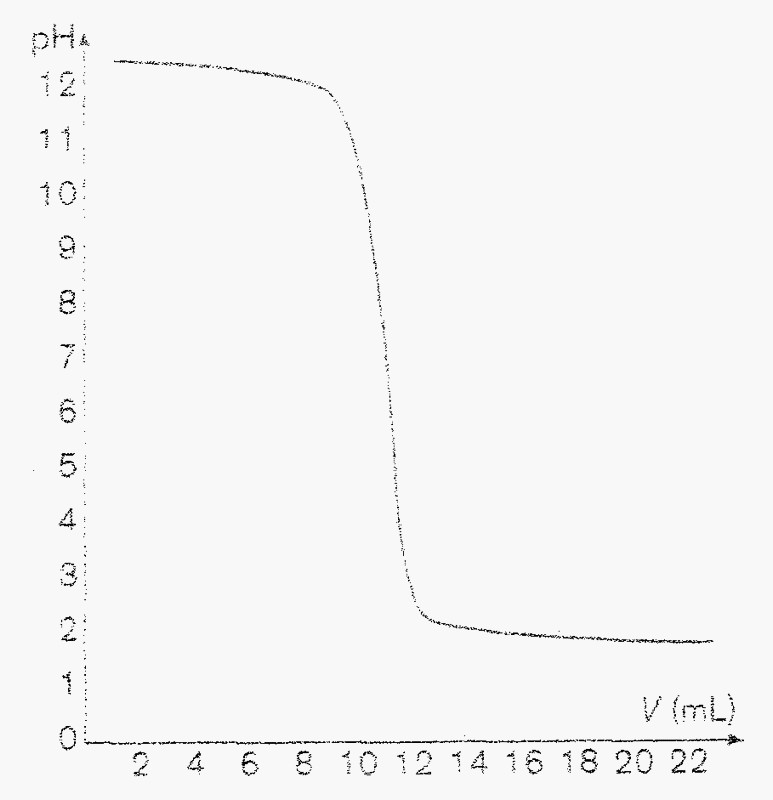
Au cours d'un dosage acide-base, Michel a introduit un volume V1=10mL d'une solution (1) de concentration inconnue dans un bêcher qu'il a dosée à l'aide d'une solution (2) de concentration C2= 0,12mol.M-1 . La courbe de titrage obtenue à l'aide d'un système EXAO est représentée ci-dessous.
1) Quelle est la nature de la solution (1) introduite dans le bêcher?
2) Quelle est la nature de la solution (2) introduite dans la burette?
3) Par la méthode des tangente nous avons déterminé le volume V2=10,5mL de solution (2) versé à l'équivalence.
Déterminez graphiquement le pH de la solution à l'équivalence.
4) En appliquant la relation V1 x C1 = V2 x C2, déterminez la concentration de la solution (1)
Merci par avance 
Salut,
1 et 2) d'après la courbe c'est quoi la nature?
3 et 4) tout est dit dans la question ,il suffit d'appliquer
Bonjour audreymaxou :
H3O+ + OH- =====> 2 H2O
1). solution alcaline .
2). solution acide
3). becher contient 10 ml de C1 ( concentration X ) . La burette contient 10,5 ml de concentration C2 = 0,12 mol/L .
4). V1 x C1 = V2 x C2 donc C1 = 10 x (X) = 10,5 x 0,12 = 10X = 1,26 : 10 = 0,126 mol/L .
La solution alcaline est légèrement plus concentrée que la solution référentielle acide . ( facteur de correction = 0,126 : 0,12 = 1,05 )
Bonnes salutations.
Salut Molécule,
1) On dit juste solution basique maintenant
Par contre, je reviens aussi vers toi pour un problème sur le mercure,
tu peux jeter un coup d'oeil au post :
https://www.ilephysique.net/sujet-probleme-260452.html
Merci beaucoup pour vos réponses lamat et molécule10 ! 
Pour le graphique par contre je sais pas comment je dois faire...
Bonsoir lamat :
D'abord oui pour solution basique ( NaOH , KOH ) ! Mais pour moi je préfère parler de solutions alcalines car s'il on a des solutions ammoniaque ou amines se sont aussi
des solutions basiques ! le mot alcaline différencie mieux le type de base .....!
Maitenant concernant le mercure :
Le mercure existe à divers degrés d'oxydation : 0 (mercure métallique), I (ion mercureux Hg22+, Hg2SO4), II (ion mercurique Hg2+, HgO, HgSO3, HgI+, HgI2, HgI3-, HgI42-).
Le mercure métallique n'est pas oxydé à l'air sec. Cependant, en présence d'humidité, le mercure subit une oxydation. Les oxydes formés sont Hg2O à température ambiante, HgO entre 573 K (300 °C) et 749 K (476 °C). L'acide chlorhydrique (HCl) et l'acide sulfurique (H2SO4) dilué n'attaquent pas le mercure élémentaire. En revanche, l'action de l'acide nitrique (HNO3) sur le mercure Hg produit HgNO3. L'eau régale attaque également le mercure : du mercure corrosif HgCl2 est alors produit.
L'oxyde mercureux Hg2O est noir ; HgO est rouge mais peut-être aussi jaune . Une jolie expérience consiste à placer dans une éprouvette un peu d'oxyde rouge de mercure
puis chauffer avec un bec de gaz . On observe une décomposition du solide avec formation de gouttelettes de mercure métallique et un dégagement d'oxygène O2 ;
voir avec la combustion d'une matière organique. ( expérience dangereuse ). 2 HgO =====> 2 Hg + O2
Concernant le sulfure mercurique : Dans la nature on le trouve sous forme de métacinabre noir qui se transforme par chauuffage en forme rouge dit cinabre .
Le mercure est extrait par oxydation à chaud du ( meta ) ou cinabre . HgS + O2 =====> Hg + SO2 et après 2 SO2 + O2 ====> 2 SO3 ( + H2O ==> H2SO4 ) .
Tu peux trouver encore beaucoup de renseignements sur Google .
Dans mon labo , j'avais une petite pompe à vide qui fonctionnait par distillation de mercure métallique ; j'obtenais un bon vide environ 10^-3 mmHg ( utilisé pour des
petites distillations ).
Voila , j'espère t'avoir donner des informations comme désirées précédemment . Bonnes salutations .
Molécule,
je t'ai répondu sur le post du mercure encore merci mais je ne crois pas que Baeza a eu sa réponse pourrais-tu réétudier la question.
Ta réponse sur la solution alcaline est certainement plus juste, la mienne est plus scolaire, j'avais hésité à dire base forte ce qui à l'air de correspondre à la définition de solution alcaline (désolé, je ne me souviens pas avoir utilisé ce terme en classe).
A bientôt j'espère


