Inscription / Connexion Nouveau Sujet
acide,base
Bonjour, je suis en bac+1,5 (je passe en seconde année) et je dois retrouver un niveau de S alors que je viens d'une section bac pro... Du coup, je viens ici me faire aider un peu, reprendre les bases et décoller de mon 2,5 de moyenne !
Un exercice qui va vour paraitre bête mais je suis obligé de commencer par quelques choses... (Du coup, je me demande si mes exercices doivent etre dans la section Lycée ou Etudes sup' ?)
Merci d'avance de votre aide précieuse pour une (GROSSE) débutante 
I) ACIDE/BASE
1) Donnez la définition et un exemple d'un acide fort, acide faible, base forte et base faible.
réponse: Un acide fort céde un ion H+ et se dissocie totalement dans l'eau. Ex: HCl
Un acide faible céde un ion H+ et ne se dissocie pas totalement dans l'eau. Ex: CH3COOH (vinaigre, acide acétique)
Une base forte capte un ion H+ et se dissocie totalement dans l'eau. Ex: NaOH (hydroxyde de sodium)
Une base faible capte un ion H+ et ne se dissocie pas totalement dans l'eau. Ex: NH4OH (ammoniaque)
2) Donner le but et le principe d'un dosage acide base.
réponse: Le but est de trouver la concentration d'un des soluté. Le principe d'incorporer un acide au fur et a mesure dans une base en prélevant le Ph entre chaque incorporation de l'acide.
3) Donnez l'allure des courbes de dosage ainsi que les informations déduites de ces courbes lord du dosage.
a) D'une base forte par un acide fort. réponse: La courbe va partir du haut Ph sup. 7 pour descendre Ph inf. 7
b) D'un acide faible par une base forte. réponse: la courbe va partir du bas Ph inf. 7 pour aller vers le haut Ph sup. 7
Merci d'avance.
Edit Coll : topic déplacé à la demande de shadowmiko 
Salut !
!
I) 1- ok pour les définitions
2- là tu es sur le cas du dosage pH-métrique mais ce n'est pas le seul procédé existant. Essaie de préciser davantage et donne le rôle de l'équivalence (c'est qd même le point clé du dosage)
3- tu peux joindre des figures stp, je vois en gros ce que tu veux dire mais au cas où j'aurais aimé les figures
Merci Shadowmiko !
Pour le 2- c'est le seul truc qu'on a fais en cours 
Le rôle de l'équivalence, je comprend pas bien ce que tu dis... Tu parles du dosage de chaque liquide par rapport a celui de l'autre liquide ?
3- je sais pas comment faire une figure donc je vais te faire par rapport a ce gif
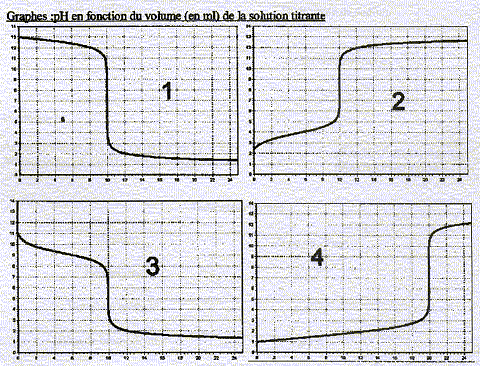
Base fort/acide forte = figure 1
acide faible/base forte = figure 4
Edit Coll : image placée sur le serveur de l'  Merci d'en faire autant la prochaine fois !
Merci d'en faire autant la prochaine fois ! 
![]()
2- tu peux occulter ce rôle par définition mais je pense que c'est bien de le rappeler.
Titrer une espèce chimique en solution consiste à déterminer la concentration molaire de cette espèce dans la solution.
Ainsi on détermine la quantité de matière de cette espèce présente dans un volume donné de cette solution.
Je te donne un lien vers la fiche du site : ![]() [lien]
[lien]
L'équivalence est atteinte lorsque les réactifs (espèce titrée et espèce titrante) ont été mélangés dans les proportions stoechiométriques. Donc à l'équivalence, il y a changement de l'espèce limitante : avant l'équivalence, l'espèce limitante est l'espèce titrante tandis qu'après l'équivalence, l'espèce limitante est l'espèce titrée.
3-prq donc? Qu'est-ce-qui te permet de l'affirmer? J'aimerais que tu fasses une démonstrations à partir d'exemple (soude sur acide chlorhydrique par exemple, et dosage de l'acide éthanoïque par de la soude)
3- Une démonstration d'une expérience "réelle" ?
Donc il faudrait que je prenne un volume de Soude 1 et un volume d'acide chlorydrique 2 que je calcule la quantité de matière, et que je fasse pareil mais avec un volume de Soude 2 et un volume d'acide chlorydrique 1 ? Et que je compare les deux pour voir la tendance de la courbe ?
Tu prends de la soude à une mole par litre et de l'acide à une mole par litre. Mais peu importe les valeurs ce qui m'intéresse c'est le raisonnement
Si tu bloques je te ferai un résumé ne t'inquiète pas
Je calcul la concentration d'une mole de soude dans 1L, et je calcul la concentration d'une mole d'acide dans 1L.
Si concentration de soude < concentration acide la courbe ira vers un ph>7
Si concentration de soude > concentration acide la courbe ira vers un ph<7
Mais c'est pas vraiment logique car si on a deux concentration égal sa fera pas un ph=7 car y'a des base forte/faible et acide fort/faible...
Je me suis trompée..
Si concentration de soude < concentration acide la courbe ira vers un ph<7
Si concentration de soude > concentration acide la courbe ira vers un ph>7
Allez je vais prendre d'autres valeurs:
Soit 1 solution de soude de concentration Cb inconnue et de volume Vb=100 mL) par HCl (Ca=0,1 mol/L et volume V variable)
La réaction de titrage c'est HO- + H3O+ ---> 2H2O
On a effectivement la courbe 1
Lorsque V
Si on interprète la courbe avec ces valeurs on a Ve=10 mL d'où Cb = 10-2 mol/L
A toi pour acide faible/base forte
attend attend j'essaye de comprendre au passage 
donc puisque HO- + H3O+ ---> 2H2O donc la soude devient de l'eau... L'eau étant neutre, sa va de l'état de basique a celui de neutre donc la courbe va vers le "haut" ?
Ah non au contraire elle va "vers le bas".
J'ai une partie de ma phrase qui n'est pas passée dsl:
V
ah oui, pardon j'ai un problème entre acide et basique, enfin il me faut réfléchir deux fois pour etre sur !
Basique>7, acide<7, donc oui si la courbe part de basique (au dessus de 7) pour aller vers 7, donc elle descend.
Si si ta phrase est passée !
Donc, plus il y a des ions H3O+ plus la solution sera acide.
Donc avec un acide faible/base forte (dosage de l'acide éthanoïque par de la soude)
CH3COOH+NaOH > CH3COO- + H+ + Na+ + OH-
...
Du coup, on part du basique pour aller vers l'acide. Car c'est une base forte et que a l'arrivé on a des ions oxonium signe que c'est acide.
Ok parce-que moi je ne la vois pas je ne sais pas pourquoi...
Donc, plus il y a des ions H3O+ plus la solution sera acide.
On considère le dosage d'une solution d'acide éthanoïque de concentration Ca inconnue et de volume Va=100 mL par de la soude (Cb=0,1 mol/L et volume V variable)
La réaction de titrage c'est HO- + CH3COOH ---> H2O + CH3COO-
Du coup, on part du basique pour aller vers l'acide. Car c'est une base forte et que a l'arrivé on a des ions oxonium signe que c'est acide.

Dsl interruption Tour de France^^
Oui elle va vers le haut ce qui correspond à la figure 2.
Rq : pour les faibles valeurs de V l'allure d ela courbe est sensiblement différente de celle obtenue pour un acide fort. Elle est ici incurvée
Les informations déduite des courbe ce sont le faite qu'elles deviennent "de plus en plus" basique ou acide ?
"'équivalence est atteinte lorsque les réactifs (espèce titrée et espèce titrante) ont été mélangés dans les proportions stoechiométriques. Donc à l'équivalence, il y a changement de l'espèce limitante : avant l'équivalence, l'espèce limitante est l'espèce titrante tandis qu'après l'équivalence, l'espèce limitante est l'espèce titrée."
l'équivalence c'est pas Pka ?


