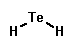Inscription / Connexion Nouveau Sujet
Liaisons covalentes
Bonjour à tous et à toutes, un exercice de physique chimie me pose problème, j'ai compris la question une et deux, mais al troisième...je coince.
Le numéro atomique de l'élément tellure est Z=52.
1- Rechercher son symbole chimique dans le tableau périodique et indiquer à quelle famille il appartient.
2- En déduire le nombre d'éléctrons externes de l'atome isolé de tellure et le nombres de liaisons formées par le tellure.
3- Donner la représentation de Lewis et la formule brute de la molécule qu'il forme à l'état de corps pur simple.
Pour la question 1, j'ai dit que le symbole était Te, qu'il appartenait à la famille des non-métaux.
Pour la deux et le nombre d'électrons externes j'ai mis 6 par rapport à la structure éléctronique ..?
Je ne sais pas comment indiquer les liaisons formées ni pour la représentation de Lewis ...  Si quelqu'un avait l'amabilité de m'expliquer ...
Si quelqu'un avait l'amabilité de m'expliquer ...
Salut!
1) C'est Te. Il se trouve dans la colonne VI A et appartient à la famille des métalloïdes.
2) et 3) méthode:
Écrit la structure électronique de l'atome.
Trouve le nombre ne d'électrons externes de l'atome.
Trouve le nombre nl de liaisons covalentes que doit établir l'atome pour acquérir une structure en octet (8 - ne ) ou en duet (2 - ne ) suivant la règle à laquelle il est soumis
Trouve le nombre nnl de doublets non liants de chaque atome grace à cette formule c'est + simple:
nnl=(ne-nl)/2
On peut alors dessiner la représentation de Lewis :
Place le(s) doublet(s) liant(s) entre les atomes de la molécule (liaisons covalentes).
Place le(s) doublet(s) non liant(s) autour des atomes qui en possèdent
Vérifie que chacun des atomes de la molécule satisfait à la règle de l'octet en étant entouré de 4 doublets (ou d'un seul doublet pour la règle du duet).
Ok?
Mais justement, la structure éléctronique sauf erreur, c'est :
(K)2 (L)8 (M)18 (N)18 (O)6 donc a priori il y aurait six éléctrons externes non ? Mais j'ai pas compris à la base ce qu'était les liaisons covalentes, notre prof est du genre a vouloir terminer son programme le plus vite possible ...
J'ai pas trop le temps de t'expliquer en détails ceci peut plus t'aider:
![]() salut
salut
Pour la famille du tellure dit plutôt chalcogène c'est plus correct (tu peux mettre les 2).
Sinon oui ta structure électronique est juste
Hin... je ne la comprends pas ...
Trouve le nombre nl de liaisons covalentes que doit établir l'atome pour acquérir une structure en octet (8 - ne ) ou en duet (2 - ne ) suivant la règle à laquelle il est soumis
Trouve le nombre nnl de doublets non liants de chaque atome grace à cette formule c'est + simple:
nnl=(ne-nl)/2
On peut alors dessiner la représentation de Lewis :
Place le(s) doublet(s) liant(s) entre les atomes de la molécule (liaisons covalentes).
Place le(s) doublet(s) non liant(s) autour des atomes qui en possèdent
Vérifie que chacun des atomes de la molécule satisfait à la règle de l'octet en étant entouré de 4 doublets (ou d'un seul doublet pour la règle du duet).
--' oui enfin, si la première ainsi que la seconde question est " élucidée " reste la troisième. Qu'est ce que " la formule brute de la molécule qu'il forme à l'état de corps pur simple " ?
Si ne= 6 et que nI= 2 selon la formule que tu as donné precedement, donc nnI= (ne-nI)/2 on aurait 6-2/2 qui serait égale à 2 et ça ferait 2 doublets non liants de chaque atome ?
Désolé j'étais partie manger
Il se combine avec l'hydrogène ou certains métaux pour former des dérivés telluriques, comme l'hydrure de tellure H2Te et le tellurure de sodium Na2Te.
Tu as également un minéral, la tellurite, de formule TeO2 (appelé aussi dioxyde de tellure)---> 
Une présence humaine! Mais des trois formules que tu viens de donner, c'est la formule TeO2 la formule brute de la molécule qu'il forme à partir de l'état de corps pur simple, non ?
Dans ce cas, si cette formule est la plus appropriée, la représentation de Lewis se traduira par Te au centre, avec deux branches O non ?
Dans la représentation oui, mais elle est combinée avec autre chose, alors que la question demande l'état de corps pur simple ..?
Fort bien fort bien  Je m'incline
Je m'incline
Es ce que pour faire court, on pourrait dire ; formule de la molécule qu'il forme à l'état de corps pur simple: H2Te avec la représentation que tu as mises au dessus ? ( ce n'est certes pas court mais parait il qu'il faut toujours faire des phrases )
Trugarez pour ton aide Shadowmiko  Moi même je pense que je n'aurai pas pu consacrer autant de temps pour quelqu'un d'autre que moi
Moi même je pense que je n'aurai pas pu consacrer autant de temps pour quelqu'un d'autre que moi 
Ah breton
Il n'y a pas de quoi et je suis là pour ça tkt
Bona serada e bona contunhament segon l'seguida
Adiù
 Si on commence a jouer avec les langues, on a pas terminer ^^ Pourrais je me permettre de grignoter de ton temps pour poser une autre question concernant un autre exercice ? ( La suite au prochain topic j'imagine ..)
Si on commence a jouer avec les langues, on a pas terminer ^^ Pourrais je me permettre de grignoter de ton temps pour poser une autre question concernant un autre exercice ? ( La suite au prochain topic j'imagine ..)
 T'as bien raison lol.
T'as bien raison lol.
De chimie? Si c'est qu'une question... Si c'est un nouvel exo tu dois créer un new topic