Inscription / Connexion Nouveau Sujet
salut
bonsoir, je ne comprends pas grand chose sur les doublet liant et les doublets non liants et plus precisement comment les calculer pouvez vous m'aider car je ne sais pas nn plus les representer avec les traits svp ?
merci.
Bonsoir et bonne année!
qu'est-ce-qui te gêne exactement ds ta leçon?
Pour savoir le nb de doublets liants et non-liants, il faut d'bord svoir le nb d'électrons sur la couche externe.
Ensuite tu les représentes autour du noyau, etc.
C'est quoi précisémet le pb?
I ) Règles du duet et de l'octet :
1) Stabilisation d'un atome :
Lorsque les atomes subissent des transformations en créant un ion monoatomique ou des liaisons avec d'autres atomes, ils le font pour saturer leur couche externe.
Ceux dont la couche externe est déjà saturée, ne donneront donc pas d'ion monoatomique et ne créent pas de liaison avec d'autres atomes.
Ils sont "chimiquement stables". Ils ont une grande inertie chimique.
2) Règle du duet :
Au cours de leurs transformations chimiques, les atomes caractérisés par Z < 4 (ou égal) évoluent de manière à saturer leur couche (K).
Ils acquièrent un "duet" d'électrons (2 e-)
3) Règle de l'octet :
Au cours de leurs transformations chimiques, les atomes caractérisés par Z > 4 évoluent de manière à saturer leur couche externe (L) ou (M) etc....
Ils acquièrent un "octet" d'électrons ( 8 e-)
Il y a des exceptions à la règle de l'octet qui ne sont pas étudiées en cours de seconde.
4) Charge des ions monoatomiques :
L'application de ces règles permettent de prévoir la charge et la formule de la plupart des ions monoatomiques.
Exemples : atome de chlore Z = 17 ; formule électronique est: (K)2(L)8(M)7.
Il possède 7 électrons sur sa couche externe (M). Pour saturer sa couche externe , il gagne un électron (charge négative) et devient l'ion chlorure Cl-
atome de sodium Na Z = 11 ; formule électronique est: (K)2(L)8(M)1
Pour saturer sa couche externe , il perd un électron et devient l'ion sodium Na+
II ) Formation des molécules :
1) Liaison covalente :
Une liaison covalente entre deux atomes correspond à la mise en commun d'un électron par atome de leurs couches externes pour former un doublet d'électrons appelé doublet liant.
Le doublet liant, mis en commun entre les deux atomes, est considéré comme appartenant à chacun des atomes liés. Ainsi en créant une liaison (ou plus) , il "acquière" un électron de plus (ou plus) et sature sa couche externe.
2) Nombre de liaisons covalentes établies par un atome :
Le nombre de liaisons covalentes que peut former un atome est égal au nombre d'électrons qu'il doit acquérir pour saturer sa couche externe à un octet d'électrons (ou un duet pour l'atome d'hydrogène).
Le nombre de liaisons n est égal au nombre maximal nmax d'électrons moins le nombre p d'électrons périphériques d'un atome :
n = nmax - p
Atome
Z
formule électronique
Nombre de liaisons
Hydrogène H
1
(K)1
n = 2 - 1 = 1
Chlore Cl
17
(K)2(L)8(M)7
n = 8 - 7= 1
Oxygène O
8
(K)2(L)6
n = 8 - 6 = 2
Azote N
7
(K)2(L)5
n = 8 - 5 = 3
Carbone C
6
(K)2(L)4
n = 8 - 4 = 4
3) Représentation de Lewis des molécules.
Les doublets liants définis précédemment assurent les liaisons entre les atomes.
Les doublets non liants sont les paires d'électrons qui ne servent pas de liaisons entre deux atomes.
La représentation de Lewis d'une molécule fait apparaître tous les atomes de la molécule et tous les doublets liants et non liants.
Dans la représentation de Lewis, la règle du "duet" doit être satisfaite pour chaque atome d'hydrogène et la règle de "l'octet" pour tous les autres atomes.
Méthode pour établir la représentation de Lewis d'une molécule :
On définit d'abord celle des atomes présents dans la molécule.
On cherche le nombre d'électrons de la couche externe que l'on répartit en 4 cases (couches L, M, N …) ou 1 case pour la couche K.
On place 1 e- par case en remplissant le maximum de case , avant de compléter à 2 e- .
Exemple: chlorure d'hydrogène HCl. ( H : Z = 1 ; Cl : Z = 17.)
H : 1 électron périphérique (couche externe K) , 1 case remplie avec 1 e-
Cl : 7 électrons périphériques. (couche externe M), 4 cases
(3 doublets non liants et 1 électron célibataire)
H établit 1 liaison covalente et Cl établit 1 liaison covalente..
représentation de Lewis de la molécule : voir en bas
III ) Géométrie des molécules.
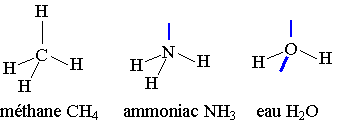
1) Disposition spatiale des doublets.
Les doublets liants et non liants se repoussent et la disposition spatiale d'une molécule est liée à cette répulsion, de façon à ce qu'ils soient le plus loin possible.
exemples : voir en bas
Le trait bleu symbolise un doublet non liant.
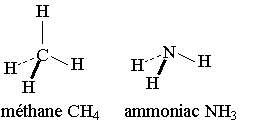
La molécule de méthane a une forme géométrique tétraédrique, la molécule d'ammoniac a une forme géométrique pyramidale et la molécule d'eau a une forme géométrique coudée plane.
2) Représentation en perspective de Cram.
Règles :
Les liaisons situées dans le plan de la feuille sont dessinées en traits pleins.
Les liaisons situées en avant du plan de la feuille sont dessinées en traits épaissis.
Les liaisons en arrière du plan de la feuille sont dessinées en pointillés.
IV ) Isomérie :
1) Les formules d'une molécules. :
* formule brute : On indique le symbole et le nombre des atomes présents : C2H6O
* formule développée : elle fait apparaître tous les atomes et toutes les liaisons entre les atomes du composé.
Les angles entre les liaisons sont en général de 90° ; (ou de 120° ).
* formule semi-développée : elle fait apparaître tous les atomes et toutes les liaisons entre ces atomes à l'exception des liaisons avec les atomes d'hydrogène. CH3-CH2-OH
2) Isomères.
Des isomères sont des composés qui ont la même formule brute mais des formules développées ou semi-développées différentes.
Les deux composés proposés en exemple, de même formule brute C2H6O, sont des isomères :
éthanol : CH3-CH2-OH et oxyde de diméthyle : CH3-O-CH3
Les isomères n'ont pas les mêmes propriétés physiques et chimiques.
Non j'ai pas encore installé de logiciels sur cet ordi donc je me suis contentée de rechercher sur Google image
en tapant le nom et le représentation qu'on veut aucun pb
en revanche sur l'autre ordi, j'avais dégoté un logiciel spécial mais il me servait pas souvent, je te dirais le nom...
oups j'ai oublié de répondre à la question
grrr
Écrit le nom et la formule brute de la molécule.
Écrit la structure électronique de chaque atome.
Trouve le nombre ne d'électrons externes de chaque atome.
Trouve le nombre nl de liaisons covalentes que doit établir l'atome pour acquérir une structure en octet (8 - ne ) ou en duet (2 - ne ) suivant la règle à laquelle il est soumis
Trouve le nombre nnl de doublets non liants de chaque atome grace à cette formule c'est + simple:
nnl=(ne-nl)/2
On peut alors dessiner la représentation de Lewis :
Place le(s) doublet(s) liant(s) entre les atomes de la molécule (liaisons covalentes).
Place le(s) doublet(s) non liant(s) autour des atomes qui en possèdent
Vérifie que chacun des atomes de la molécule satisfait à la règle de l'octet en étant entouré de 4 doublets (ou d'un seul doublet pour la règle du duet).
Ok?
Dès que je trusterai l'ordi de mon frère que regarderai...
Je crois qui avait Atom dedans et que c'était un nom anglais mais j'en suis pas sûre...
Promis je te tiens au courant

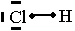

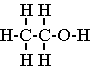
 Bravo Amandine
Bravo Amandine 
