Inscription / Connexion Nouveau Sujet
L'eau de javel / dosage indirect
Tout d'abord bon jour à tous:
L'eau de javel est une solution aqueuse basique contenant entre autre des ions hypochlorite, ClO- (principe actif) et des ions chlorure Cl-.
Préparation de l'eau de javel:
On réalise l'électrolyse (réaction forcée d'oxydoréduction) d'une solution aqueuse de chlorure de sodium. Il se forme du dichlore gazeux et du dihydrogène H2 gazeux. Lors de cette réaction forcée, un indicateur acidobasique (la phénophtaléine) indique que le milieu devient fortement basique ( présence d'une base en solution).
L'équations bilan de cette électrolyse est : 2Cl-(aq)+2H2O==>Cl2(g)+H2+2HO-
1) Expliciter cette transformation
Alors là je ne comprend pas la question!
Le dichlore ainsi obtenue est mis en présence d'une solution aqueuse basique d'hydroxyde de sodium (Na+;HO-) : le dichlore se dismute en ions hypochlorite, ClO- et en ions Cl-.
2) Rappeller la définition d'une réaction de dismutation.
On appelle dismutation une réaction d'oxydoréduction où un même réactif joue à la foi le rôle d'oxydant et de réducteur.
3) Écrire les demis équations électroniques (en milieu basique) et les couples oxydant/réducteur correspondant.
Cl2+ 2 H2O+4HO- = 2ClO- + 4HO- +2e- :ClO-/Cl2
Cl2 +2e-= 1Cl- :Cl2/Cl-
4) En déduire l'équation bilan de cette réaction spontanée.
l2 +2 H2O ==>2ClO- + 2Cl-
5)Expliquer pourquoi j'eau de javel est un mélange équimolaire d'ions hypochlorite et d'ions chlorure.
Je n'ai jamais eu à faire a ces question de ce type mais je pense parce que c'est le nombre stchiométrique devant ClO- et Cl-
Dosage indirect de l'eau de javel:
On prélevé un volume V1=10.0mL d'eau de javel de concentration [ClO-] inconnue.
On ajoute ensuite une solution aqueuse de iodure de potassium (K+;I-)(aq) en excès!:il se forme du diiode (I2 (aq)) et l'ion chlorure Cl-(as) : réaction (1)
6) Quel test permet de mettre en évidence la présence du diiode?
Je ne suis pas sur mais je pense que c'est l'empois d'amidon.
7)Écrire les deux demis équations électronique intervenant dans cette transformation et les couples oxydant/réducteur correspondant.
ClO- +2H+ +e- = l- +H20 :ClO-/Cl-
2I-= I2 + 2e- :I2/I-
8) En déduire l'équation de la réaction(1)
2Clo-+ 4H+ +2I- ==>2Cl- +2H2O + I2
Cette réaction ne permettant pas de réaliser un dosage (difficulté à repérer l'équivalence), on dose la quantité de diiode formé,à l'aide d'une solution aqueuse d'ions thiosulfate S2O32- de concentration [S2O32-]=1.0E-1 mol.L-1
9)Ecrire les demis équations électroniques associée aux xouples I2/I- et S4O62-/S2O32-
La ça commence à s'embrouiller dans mon esprit toutes ces réactions:
je vais passer directement à la question d'après.
10) En déduire ma réaction (2) entre le diiode I2 formé et l'ion thiosulfate S2O32-.
I2 +2S2O32-==>2I- +S4O62-
Ensuite je suis totalement perdu pour les autres questions:
Lors de ce dosage, on détermine un volume équivalent Ve=15.0mL
11) Quelle relations peut-on écrire entre les quantité de réactifs de l'équation (2) à l'équivalence.
12)En déduire la quantité de diiode ayant réagit dans cette réactio (2)
13) Sachant que cette quantité de diiode a été formée lors de la réaction (1), quelle quantité d'ions ClO- a réagit lors de cette réaction(1)
14) En déduire la concentrations [ClO-] de la solution d'eau de javel étudiée.
Je sais cela vous fait beaucoup de lecture pour un seul exercice mais je vous en serais reconnaissant de vouloir m'aider pour les questions ou je n'arrive pas et de m'indique les fautes éventuelle que j'aurais commise. MERCI
Bonjour,
1. Réaction acido-basique : l'indicateur traduit la présence d'HO- dans la solution
2. oui
3.Cl2 +2e-= 2Cl- (attention !)
Cl2 +2H2O = 2ClO- + 4H+ + 2e-
4.2Cl2 +2 H2O ==>2ClO- + 2Cl- + 4H+ (attention !)
5. oui ! TB !
6. OUI !
7. ClO- +2H+ +2e- = Cl- +H20 :ClO-/Cl-
(attention !)
8. ERREUR : ClO- + 2H+ + 2I- ==>Cl- + H2O + I2
9. Pour la suite je te réfère à un exo que j'ai corrigé récemment
En plus c'est bien rédigé 
![]() Exercice Oxydoréduction/Dosage 1re S
Exercice Oxydoréduction/Dosage 1re S
Merci gbm j'ai retrouvé l'origine de mes erreurs
Par contre je n'ai toujours pas tout compris pour la question 1
Cette transformation est une transformation d'oxydoréduction sauf qu'il apparaît l'ion hydroxyde qui rend le milieu basique
ET pour le reste c'est pas vraiment pareil: le début est identique mais la ou je ne comprend pas rtop c'est avec le dosage indirect
Lors de ce dosage, on détermine un volume équivalent Ve=15.0mL
11) Quelle relations peut-on écrire entre les quantité de réactifs de l'équation (2) à l'équivalence.
12)En déduire la quantité de diiode ayant réagit dans cette réactio (2)
13) Sachant que cette quantité de diiode a été formée lors de la réaction (1), quelle quantité d'ions ClO- a réagit lors de cette réaction(1)
14) En déduire la concentrations [ClO-] de la solution d'eau de javel étudiée.
C'est cette partie là qui est flou pour moi
C'est dans l'exercice que j'ai fait :
11- L'équivalence est atteinte quand les réactifs de la réaction du dosage ont été introduits dans des proportions stoechiométriques.
12- L'équation de la réaction du dosage est 2S2O32- (aq) +1I2 (aq) ------> 2I-(aq) + S4O62- (aq) .
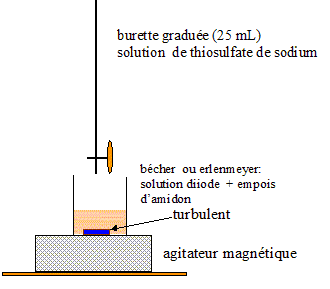
Schéma annoté du dosage à faire :
dans la burette : (2Na+ + S2O32-)
- de concentration C =0,10mol/L
- de volume VE = 15x10-3 L = volume versé à l'équivalence.
dans le bécher : le diiode
- de volume V1 = 1.5- L'équivalence est atteinte quand les réactifs de la réaction du dosage ont été introduits dans des proportions stoechiométriques.
1.6- L'équation de la réaction du dosage est 2S2O32- (aq) +1I2 (aq) ------> 2I-(aq) + S4O62- (aq) .
Schéma annoté du dosage à faire :
dans la burette : (2Na+ + S2O32-)
- de concentration C1 =0,10mol/L
- de volume VE = 4,2x10-3 L = volume versé à l'équivalence.
dans le bécher : le diiode
- de volume V1 =10x10-3 L
- de concentration C2 = inconnue.
A l'équivalence,
n(I2 dans Va)/1 = n(S2O32- dans VE)/2 (les coefficients sont ceux devant les réactifs dans l'éqation du dosage)
<=> C2*V2 = C1*VE
<=> C2 = ......
Tu peux en déduire la quantité de matière de diiode
Houlà il y a eu un bug:
11- L'équivalence est atteinte quand les réactifs de la réaction du dosage ont été introduits dans des proportions stoechiométriques.
12- L'équation de la réaction du dosage est 2S2O32- (aq) +1I2 (aq) ------> 2I-(aq) + S4O62- (aq) .
Schéma annoté du dosage à faire :
dans la burette : (2Na+ + S2O32-)
- de concentration C =0,10mol/L
- de volume VE = 15x10-3 L = volume versé à l'équivalence.
dans le bécher : le diiode
- de volume V1 = 1.5- L'équivalence est atteinte quand les réactifs de la réaction du dosage ont été introduits dans des proportions stoechiométriques.
A l'équivalence,
n(I2 dans Va)/1 = n(S2O32- dans VE)/2 (les coefficients sont ceux devant les réactifs dans l'éqation du dosage)
<=> C2*V2 = C1*VE
<=> C2 = ......
Tu peux en déduire la quantité de matière de diiode
Puis tu mets à côté de la burette :
(2Na+ + S2O32-)
- de concentration C =0,10mol/L
- de volume VE = 15x10-3 L = volume versé à l'équivalence.
et à côté du bécher :
dans le bécher : le diiode
- de volume V1 = 10x10-3 L
- de concentration C1 inconnue